چکیده
زئولیت های طبیعی، منابعی فراوان و ارزان هستند که به صورت آلومینوسیلیکات های هیدراته کریستالی با یک ساختار چارچوبی حاوی منافذی پُر از آب، کاتیون های قلیایی و قلیایی – خاکی می باشند. به دلیل توانایی بالای آنها در تبادل کاتیون، همچنین خواص غربال مولکولی، زئولیت های طبیعی در دهه های گذشته، به عنوان جاذب، کاربرد گسترده ای در فرآیندهای جداسازی و تصفیه داشته اند. در این مقاله، ما گسترش و توسعه ی اخیر زئولیت های طبیعی به عنوان جاذب در دستگاه تصفیه و فاضلاب را مورد بررسی قرار می دهیم. خواص و اصلاح زئولیت های طبیعی مورد بحث قرار گرفته است. زئولیت های طبیعی تصفیه آب مختلفی در سراسر جهان، ظرفیت تبادل یونی متفاوتی برای کاتیون هایی مانند آمونیاک و یونهای فلزات سنگین نشان داده اند. در برخی زئولیت ها نیز جذب آنیون ها و مواد آلی از محلول آبی مشاهده شده است. اصلاحات زئولیت های طبیعی را می توان با روشهای مختلفی مانند تصفیه اسید، تبادل یونی، و سورفاکتانت عاملدار انجام داد تا زئولیت های اصلاح شده به ظرفیت جذب بالاتری برای مواد آلی و آنیون ها دست یابند.
-
مقدمه
این روزها به دلیل کمبود آب، جهان با بحران آب مواجه است. با توسعه ی سریع صنایع مختلف، مقدار زیادی فاضلاب از فرایندهای صنعتی تولید می شوند که به درون سیستم های خاک و آب تخلیه می شوند. فاضلاب معمولاً حاوی آلاینده های بسیاری مانند یون های کاتیونی و آنیونی، روغن و مواد آلی هستند، که اثرات سمی بر اکوسیستم دارند. حذف این آلاینده ها مستلزم فناوری های مقرون به صرفه و انواع تکنیک های مختلفی است که در دهه های گذشته در برای مدیریت و کنترل تصفیه فاضلاب توسعه یافته اند. در حال حاضر، اعتقاد بر این است که جذب سطحی تکنیکی ساده و موقر برای دستگاه تصفیه آب و فاضلاب است و موفقیت این تکنیک تا حد زیادی بستگی به توسعه ی یک جاذب کارآمد دارد. کربن فعال [1]، مواد معدنی خاک رس [2, 3]، بیومواد [4]، زئولیت ها [5, 6]، و برخی مواد زائد جامد صنعتی [7, 8] کاربرد گسترده ای به عنوان جاذب برای جذب سطحی یون ها و مواد آلی در تصفیه فاضلاب داشته اند.
از زمان کشف اولیه ی مواد معدنی زئولیت در سنگ های رسوبی آتشفشان، توف های زئولیتی در بسیاری از نواحی جهان یافت شده اند. در دهه های گذشته، مشخص شد که زئولیت های طبیعی کاربردهای متنوعی در جذب، کاتالیز کردن، صنعت ساختمان، کشاورزی، اصلاح و پاکسازی خاک و انرژی دارند [9, 10]. برآورد شده است که مصرف جهانیِ زئولیت طبیعی، 3.98 Mt است و در سال 2010 به 5.5 Mt خواهد رسید [11].
زئولیت های طبیعی، مواد معدنی آلومینوسیلیکات هیدراته با یک ساختار متخخلخل هستند و خواص فیزیکی – شیمیایی مانند تبادل کاتیون، غربال مولکولی، کاتالیز کردن، و جذب دارند. استفاده از زئولیت های طبیعی برای کاربردهای زیست محیطی تحقیقات جدیدی به دنبال داشته است، که عمدتاً به دلیل خواص آنها و وجود قابل توجه آنها در سراسر جهان است. کاربرد زئولیت های طبیعی برای تصفیه آب و فاضلاب محقق شده و هنوز هم تکنیکی نوید بخش در فرآیندهای پاکسازی زیست محیطی است. در دهه های گذشته، کاربرد زئولیت های طبیعی بر تفکیک آمونیوم و فلزات سنگین تمرکز داشته اند، که به دلیل ماهیت تبادل یونی آنهاست و برخی از مقالات بررسی نیز در این زمینه منتشر شده اند [6, 12, 13].
صرف نظر از حضور کاتیون ها در آب، آنیون ها و ترکیبات آلی نیز به میزان گسترده ای در فاضلاب وجود دارند. در سال های اخیر، زئولیت طبیعی و فرم های اصلاح شده ی آن در تفکیک و جداسازیِ آنیون ها و مواد آلی از سیستم های آب گزارش شده اند. با این حال، چنین بررسی یافت نشده است. در این مقاله، ما تحقیق اخیر در مورد جذب کاتیون با استفاده از زئولیت های طبیعی، همچنین فرم های اصلاح شده (تغییر یافته) آن برای جداسازی آنیون ها و ترکیبات آلی در تصفیه آب و فاضلاب، بروز رسانی خواهیم کرد.
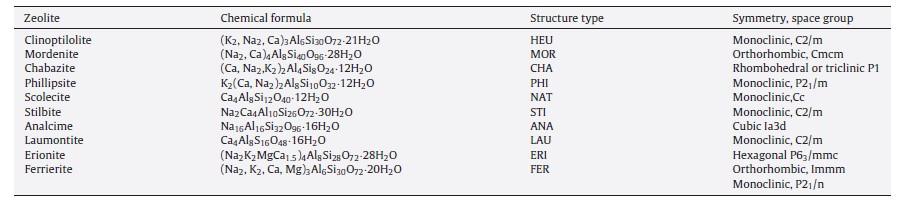
جدول 1: خواص ساختاری برخی زئولیت های طبیعی
 خواص زئولیت طبیعی
خواص زئولیت طبیعی
بسیاری از زئولیت های طبیعی در جهان شناسایی شده اند. کلینوپتیلولیت، موردنیت، فیلیپسیت، شابازیت، استیلبیت، آنالسیم و لومونتیت (Clinoptilolite, mordenite, phillipsite, chabazite, stilbite, analcime, laumontite) اَشکال بسیار رایجی هستند، در حالی که offretite, paulingite, barrerite, mazzite بسیار کمیاب هستندو در میان زئولیت ها، clinoptilolite فراوان ترین زئولیت طبیعی است و کاربرد گسترده ای در جهان دارد. در ساختار زئولیت، سه جزء نسبتاً مستقل وجود دارد: چارچوب آلومینوسیلیکات، کاتیون های قابل تعویض، و آب زئولیتی. فرمول شیمیایی کلی زئولیت به صورت است که M، (Na, K, Li) و / یا (Ca, Mg, Ba, Sr) است، n بار کاتیون است؛ .
بلوک ساختمانی اولیه ی چارچوب زئولیت، چهار وجهی است، مرکز آن از طریق یک سیلیکون یا اتم آلومینیوم اشغال شده است، و چهار اتم اکسیژن در رئوس قرار دارند. جایگزینی Si4+ با Al3+ بار منفی چارچوب را تعریف می کند، که از طریق کاتیون های یک ظرفیتی یا دو ظرفیتی که همراه با آب در یک مکان مستقر می شوند، جبران می شوند. چارچوب آمینوسیلیکات، پایدارتری و محفوظ ترین جزء است و نوع ساختار را تعیین می کند. مولکول های آب می توانند در منافذ حفره های بزرگ حضور داشته باشند و بین یونهای چارچوب و یونهای قابل تبادل از طریق پل های آبی متصل شوند. آب همچنین می تواند به عنوان پل هایی بین کاتیون های قابل تبادل مورد استفاده قرار گیرد. جدول 1 فرمول شیمیایی و ساختار برخی زئولیت های طبیعی مهم را نشان می دهد.
زئولیت ها قادر به تبادل یونها با محیط خارجی هستند، که از ویژگیهای مهم زئولیت می باشد. تبادل یونی به صورت همریخت انجام می شود. تعادل تبادل یونی از طریق معادله زیر بیان می شود:
که در اینجا و ظرفیت کاتیون های مربوطه هستند، L بخشی از چارچوب زئولیت است که بار منفی واحد را نگه می دارد.
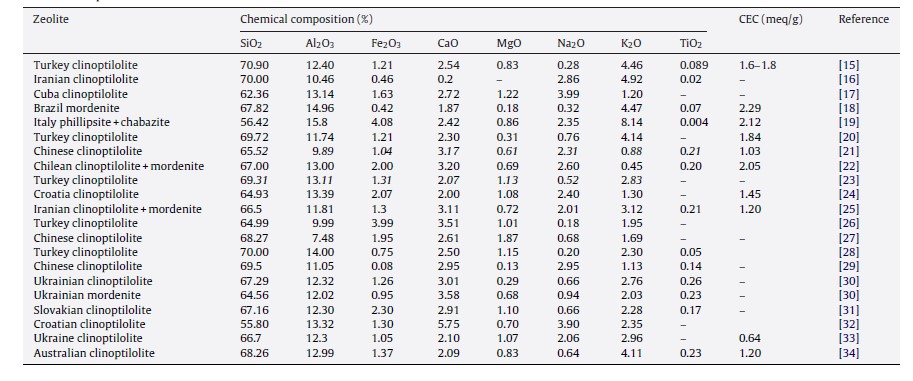
رفتار تبادل یون زئولیت طبیعی بستگی به فاکتورهای زیادی مانند ساختار چارچوب، اندازه و شکل یون، چگالی بار چارچوب آنیونی، بار آنیونی و غلظت محلول الکترولیت خارجی دارد [9, 14]. با توجه به محیط شکل گیری، زئولیت های طبیعی ترکیب شیمیایی و ظرفیت تبادل کاتیونی (CEC) مختلفی دارند. جدول 2 ترکیب شیمیایی و ظرفیت تبادل یونی زئولیت های مختلف جهان را نشان می دهد. مشاهده می شود که ظرفیت تبادل کاتیونی بین 0.6 و 2.3 meq/g می باشد.
جدول 2: ترکیب شیمیایی و CEC زئولیت های طبیعی در جهان
 اصلاح زئولیت طبیعی
اصلاح زئولیت طبیعی
ویژگیهای جذب هر زئولیتی بستگی به آرایش شیمیایی / ساختاری جاذب دارد. نسبت Si / Al، نوع کاتیون، تعداد و مکان کاتیون تاثیر ویژه ای بر جذب دارد. این خواص را می توان از طریق چندین عملیات شیمیایی تغییر داد تا کاراییِ تفکیک و جداسازی زئولیت های طبیعی خام بهبود یابد. تصفیه اسید / باز و اشباع سورفاکتانت از طریق تبادل یونی معمولاً برای تغییر خواص آبدوست / آبگریز برای جذب یون ها و مواد آلی مختلف به کار می روند.
تصفیه اسید / باز
به طور کلی، شستشوی اسیدِ زئولیت های طبیعی ممکن است موجب از بین رفتن ناخالصی هایی شود که منافذ را مسدود کرده اند، و به تدریج کاتیون ها برای تغییر به فرم – H از بین می روند و در نهایت، آلومینیوم زادیی ساختار صورت می گیرد. دو نوع اصلی روش اصلاح وجود دارد، که می توان برای تشکیل زئولیت با تبادل پروتون؛ تبادل آمونیوم پس از تکلیس و تبادل یونی مستقیم با محلول اسیدی رقیق مورد استفاده قرار داد. تبادل آمونیوم می تواند ساختار را پایدار نگه دارد، در حالی که تصفیه اسید به طور کلی موجب آلومینیوم زدایی و کاهش پایداری حرارتی می شود.
Kurama et al. [35] تبدیل یک کلینوپتیلولیت ترکیه طبیعی را برای تشکیل هیدروژن به دو روش؛ تبادل آمونیوم پس از تکلیس و تصفیف مستقیم با HCI مورد بررسی قرار دادند. آنها دریافتند تبادل یونی با H+ تاثیر زیادی بر حجم موثر حفره و مساحت سطح کلینوپتیلولیت دارد. حجم حفره یا منفذ و مساحت سطح از 0.13 به 0.25 mL/g و از 35 به 315 m2/g افزایش پیدا می کند.
Cakicioglu-Ozkan and Ulku [36] تصفیه اسید از کلینوپتیلولیت بیگادیچ با استفاده از محلول HCl با غلظت های متفاوت (0.032, 0.16, 0.32, 1.6 or 5M) و دماهای (25, 40, 75, 100̊ C) گزارش دادند. آنها دریافتند که حجم منافذ سوپر – میکرو خیلی به تصفیه اسید حساس نبود، اما مساحت سطح لانگمویر و حجم اولترا – میکرو حفره بستگی به درجه ی حذف آلومینیوم از ساختار دارد. یک زئولیت طبیعی، استیلبیت از چین، در محلول HCl داغ تصفیه شد. این روش اصلاح منجر به تغییر در آلومینیوم زدایی چارچوب شد، و زئولیت های اصلاح شده با خواص جذب و پایداری حرارتی متفاوت به دست آمد. زئولیت های با سیلیکا یا سیلیس بالا H –STI با تبادل و پس از تکلیس در هوای سیال، پایداری حرارتی را تا 1000 ̊ C با سیستم های کانال باز و کامل نشان دادند. فرم – H در زئولیت STI دارای ظرفیت تبادل یونی بالای Ag+ است [37].
پایداری و ظرفیت موثر تبادل یونی (EFcec) یک کلینوپتیلولیت مکزیکی نیز از طریق تصفیه با محلول های فسفات اسیدی مورد بررسی قرار گرفته است. نتایج نشان می دهد که PH محلول های فسفات بر ثبات و EFcec توف های غنی از کلینوپتیلولیت تاثیر می گذارد. در PH 0، آلومینیوم زدایی کلینوپتیلولیت رخ می دهد، حالت کریستالی یا بلورینگی خود را از دست می دهد و EFcec کاهش پیدا می کند. هنگامی که PH تا 4 یا 6 افزایش یابد، تغییرات در بلورینگی مشاهده نمی شود و مقدار آلومینیوم مشابه با توف غنی از کلینوپتیلولیت بدون تصفیه است، اما EFcec اندکی افزایش پیدا می کند .
سه زئولیت از ارمنستان، گرجستان و یونان با KOH رقیق تصفیه و فرآوری شدند، و بعد از آن، یا با HCl واکنش دادند یا در 700 ̊ C حرارت دیدند. تصفیه با KOH موجب افزایش اندک مساحت سطح و ریز حفره به دلیل انحلال مواد بی شکل شد. تصفیه با اسید موجب افزایش قابل توجه مساحت سطح ویژه و ریز حفره و کاهش ظرفیت تبادل کاتیون به دلیل انحلال جزئی Si – tetrahedral و پیوندهای آزاد می شود، که میکرو منافذ ثانویه را ایجاد می کنند و سایت های تبادل خاص زئولیت ها را خراب می کند. گرمایش هم مساحت سطح ویژه و هم ریز حفره را کاهش می دهد.
بنابراین، نتیجه گیری می شود که تصفیه با اسید ظرفیت تبادل کاتیون را به دلیل آلومینیوم زدایی کاهش خواهد داد، اما می تواند ظرفیت و نسبت Si / Al را بهبود بخشد که مزایایی برای جذب / جداسازی مولکول های غیر قطبی از آب یا جریان گاز ارائه می دهند.
اصلاح سورفاکتانت
به دلیل بار منفی خالص در چارچوب، زئولیت های طبیعی خام معمولاً میل ترکیبی اندکی با آنیون ها دارند یا اصلاً میل ترکیبی با آنها ندارند و جذب پایینی برای مواد آلی در محلول های آبی از خود نشان می دهند. برای تغییر خواص سطح، یک روش اصلاح که کاربرد گسترده ای دارد، استفاده از سورفاکتانت های آلی است. در گذشته، ارزیابی های زیادی در مورد اصلاح زئولیت طبیعی با سورفاکتانت های کاتیونی، و کاربرد آنها برای حذف انواع مختلف آلاینده ها از آب صورت گرفته است.
این سورفاکتانت ها، tetramethylammonium [40,41]، cetyltrimethylammonium (CTMA)[42,43]، hexadecyltrimethylammonium (HDTMA)[40,44–49]، octadecyldimethylbenzyl ammonium (ODMBA)[42,50–52]، n-cetylpyridinium(CPD) [53], benzyltetradecyl ammonium (BDTDA) [49]، stearyldimethylbenzylammonium (SDBAC)[54,55]، N,N,N, ، و polyhexamethylene-guanidine [57] هستند.
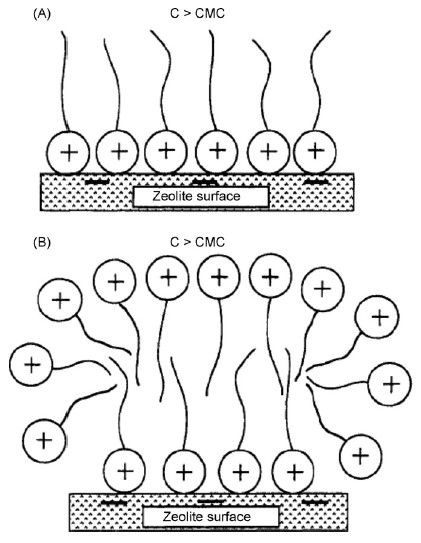
مشخص شده است که اصلاح با سورفاکتانت بستگی به درجه ی جذب سطحی سورفاکتانت در زئولیت دارد. یک مدل کلی جذب سورفاکتانت های یونی در یک سطح جامد، شکل گیری تک لایه یا “hemimicelle” در سطح مشترکِ جامد – آب از طریق پیوندهای قوی Coulombic (یونی) در غلظت های سورفاکتانت یا کمتر از غلظت بحرانی میسل (CMC) انجام می شود. اگر غلظت سورفاکتانت در محلول بیش از CMC باشد، آنگاه دنباله های (دم های) آبگریز مولکول های سورفاکتانت به هم می پیوندند تا همانطور که در تصویر 1 آمده است، یک دولایه یا “admicelle” تشکیل شود [48]. بنابراین، زئولیت اصلاح شده با سورفاکتانت می تواند یک گروه عامل پیچیده – NR+ از سورفاکتانت داشته باشد که در جهت محلول اطراف در دو لایه حرکت می کنند.
تصویر 1: تشکیل Hemimicelle (A) و admicelle (B) از طریق سورفاکتانت های کاتیونی در سطح زئولیت
کاربرد برای تصفیه آب
آب سطحی، آب زیر زمینی، و فاضلاب صنعتی و خانگی حاوی انواع بسیار متفاوتی از آلاینده ها هستند. این آلاینده ها شامل ترکیبات غیر آلی و آلی می باشند و کمابیش برای انسان، حیوانات و گیاهان خطرناک هستند. در بخش های زیر، جدیدترین کاربردهای زئولیت های طبیعی و فرم های اصلاح شده ی آنها برای از بین بردن آلاینده های مختلف از آب به طور کامل مورد بحث و بررسی قرار می گیرند.
آمونیوم
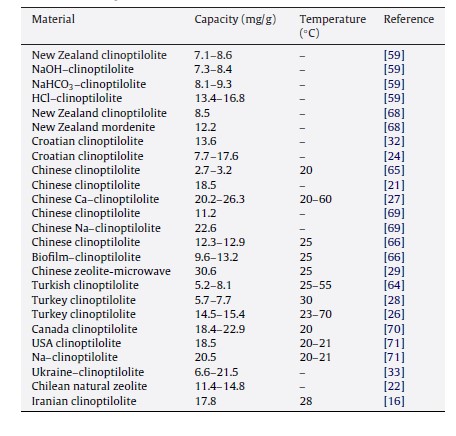
آمونیوم یک فرم یونی مهم نیتروژن در محلول آبی است. آلودگی آن عمدتاً از فاضلاب شهری، فاضلاب کارخانه تولید کود، و ضایعات کشاورزی است. نیتروژن آمونیاک در شتاب بخشیدن به انباشتگی اتروفیکاسیون یا انباشت آب دریاچه ها و رودخانه ها، تخلیه اکسیژن محلول، و سمیت ماهی ها هنگام دریافت آب نقش دارد. غلظت بالاتر آمونیوم موجب کاهش شدید اکسیژن محلول و سمیت آشکار ارگانیسم های آبی می شود. در دهه های گذشته، روش های مختلف حذف نیتروژن آمونیاکی از آب ها توسعه یافته است؛ روش های تصفیه های بیولوژیکی و جذب سطحی، کاربرد گسترده ای دارند. زئولیت طبیعی از منابع مختلف به عنوان یک جاذب موثر بررسی شده اند. جدول 3 به طور خلاصه ظرفیت جذب در انواع مختلف زئولیت های طبیعی را نشان می دهد. بر اساس این جدول، مشاهده می شود که جذب آمونیوم در زئولیت های طبیعی 2.7-30.6 mg/g می باشد.
Cooney et al. [58] یک بررسی آزمایشگاهی از زئولیت استرالیایی طبیعی، کلینوپتیلولیت، برای حذف آمونیوم از آب انجام داده اند. آنها خواص تعادلی و جنبشی تبادل آمونیوم را در زئولیت، تحت شرایط باینری و مولتی – جزء (دو جزئی و چند جزئی) مورد بررسی قرار دادند. نتایج نشان داد که بالاترین کارایی حذف و جداسازی آمونیوم در زمانی به دست می آید که سایت های (محل های) تبادل زئولیت به فرم سدیمی تبدیل شده باشند. برای یک سیستم چند – جزئی، نوعی تلاش رقابتی بین آمونیوم و سایر کاتیون ها مانند Ca2+، Mg2+، K+ وجود داشت، و گزینش پذیری زئولیت ها برای یونهای آمونیوم بیشتر ار دیگر کاتیون هایی بود که معمولاً در فاضلاب وجود دارند.
جدول 3: جذب آمونیون در زئولیت های طبیعی
Rozic et al [32] حذف یون آمونیوم از محلول های آبی را با استفاده از کلینوپتیلولیت و بنتونیت کروواسی مورد بررسی قرار دادند. بالاترین کارایی حذف برای با زئولیت طبیعی در کمترین غلظت اولیه، یعنی 100 mg به دست آمد. با افزایش غلظت اولیه ی نیتروژن آمونیاکی، کارایی حذف (جداسازی) به سرعت کاهش یافت. برای خاک رس، کارایی حذف نیتروژن آمونیاکی در یک حالت کلوئیدی مایع بالاتر بود و اصلاح اسیدی خاک رس، کارایی حذف نیتروژن آمونیاکی را کاهش داد.
یک کلینوپتیلولیت از نیوزیلند با محلول های قلیایی تصفیه شد و برای حذف یونهای از یک جریان پساب fellmongery مورد بررسی قرار گرفت [59]. مشخص شد که بعد از تصفیه، ظرفیت تبادل کاتیون زئولیت طبیعی تا 74% افزایش پیدا می کند و می تواند یک ماکزیمم بالقوه ی 18.7-20.1mg را حفظ کند. ظاهراً وجود سایر کاتیون ها در فاضلاب fellmongery با جذب یون تداخل ایجاد می کنند، که موجب می شود کسر کوچکی از CEC با یونهای اشغال شوند. زئولیت باردار کاتیونی را می توان از طریق شستشو با 0.5M HCl برای جذب یون بازتولید نمود و بعد از 12 سیکل احیا و باز تولید، جذب بدون تاثیر باقی می ماند.
Lebedynets et al. [60] مطالعه ی جذب را از محلول های آبی سنتزی (ترکیبی)، با یک کلینوپتیلولیت اکراینی انجام دادند. جذب توسط زئولیت در طی 24 ساعت برای همه اندازه های کسری، غلظت های اولیه یون و حجم های جذب شده تکمیل شد.
مقادیر یونهای جذب شده، با افزایش غلظت اولیه ی و کاهش حجم مواد جذب شده، با ماکزیمم ظرفیت جذب 11.5 mg/g افزایش یافت. Sprynskyy et al. [33] جذب را از محلول های آبی سنتزی در فرم های خام و پیش تصفیه شده ی یک کلینوپتیلولیت مشابه تحت شرایط دینامیک مورد بررسی قرار دادند. جذب زئولیت از طریق تبادل با یونهای Na+, Ca2+, K+ انجام شد. اگرچه یونهای Na+ برای هر دوی یونهای هیدروژن و آمونیوم به راحتی تبادل شدند، اما نقش یونهای Ca2+ با اشباع زئولیت توسط یونهای افزایش یافت. ماکزیمم ظرفیت جذب کلینوپتیلولیت یونهای تحتشرایط دینامیک (پویا) برآورد شده است، که به میزان قابل ملاحظه ای بالاتر از مقدار اندازه گیری شده تحت شرایط استاتیک (ایستا) بود. در یک مطالعه ی بازیافتی، اهمیت انتشار خارجی برای جذب آمونیوم توسط کلینوپتیلولیت اثبات شد. فرآوری (تصفیه) مقدماتی ماده جاذب توسط گرما، اسید و NaCl ، اهمیت عمده ی مکانیسم تبادل یونی را ثابت نمود. تصفیه ی کلینوپتیلولیت با NaCl پیشرفت در حذف آمونیوم را بیش از سایر روشهای تصفیه نشان داد.
Englert and Rubio [22] از یک زئولیت طبیعی شیلی به عنوان ماده جاذب برای تفکیک آمونیاک از محلول های آبی استفاده نمودند. آزمایشات نشان داد این ذرات به صورت منفی در یک طیف گسترده ی PH با 18.4 ظرفیت تبادل کاتیونی باردار می شود. به نظر می رسد حذف آمونیاک از طریق سینتیک (انرژی جنبشی) سریع در مقدار PH خنثی، با ظرفیت حذف تا 0.68 meq انجام می شود.
Watanabe et al. [61] اصلاح زئولیت های طبیعی ژاپنی را تحت شرایط هیدروترمال انجام دادند تا اثربخشیِ جذب یونهای آمونیوم را بهبود بخشند. این نمونه ها با محلولهای 0.1, 0.3, 1.0, 3.0 M NaOH در دماهایی از 25 تا 150 ̊ C تحت فشار خودبخودی به مدت 7 روز تصفیه شدند. پس از تصفیف هیدروترمال، تبدیل زئولیت ها به phillipsite, hydroxyl-sodalite, analcime مشاهده شد. محصولات تصفیه شده که عمدتاً حاوی phillipsite بودند، دو بار مقدار یونهای آمونیوم را به عنوان مواد راه اندازی جذب نمودند. ماکزیمم جذب یونهاب آمونیوم 34.6 mg/g بود.
Farkas et al. [24] جذب یونهای آمونیوم و آلاینده های آلی را در یک کلینوپتیلولیت برای تصفیه آب های تراوش شده از زباله ها مورد مطالعه قرار دادند. بدون پیش – تصفیه آب تراوش یافته، تبادل در زئولیت به دست آمده است. پس از پیش – تصفیه از طریق کرین فعال، تبادل یونهای آمونیوم در زئولیت تا افزایش یافت. در محلول آمونیوم، این تبادل بود، که نشان می دهد که آلاینده های آلی و یونهای K+ و Ca2+ در آب نشتی، مانع تبادل یونهای شدند.
Jorgensen and Weatherley [62] سه تبادل کننده را شامل کلینوپتیلولیت طبیعی، یک رزین ژلی (Dowex50wx8) ، و یک رزین ماکرونت (Purolite MN-500) برای حذف آمونیاک از فاضلاب پس از فرآوری (تصفیه) بیولوژیکی ثانویه مورد ارزیابی قرار دادند. نتایج نشان داد که وجود ترکیبات آلی، اثرات متغیری بر جذب یون آمونیوم دارد. برای کلینوپتیلولیت، پس از سیکل های خستگی و بازتولید، یک افزایش قابل ملاحظه ای در ستون عملکرد بریک ترو مشاهده شد. کلینوپتیلولیت بازتولید شده، ماکزیمم ظرفیت بریک ترو 450 حجم بستر نشان داد.
سینتیک (انرژی جنبشی) و تعادل جذب یون آمونیوم از محلول های آبی با استفاده از یک توف زئولیت رومانیایی و زئولیت های سنتز شده (5A, 13X, ZSM-5) توسط Maranon et al [63] گزارش شده است. تاثیر زمان تماس، PH، غلظت آمونیوم، وجود سایر انواع کاتیون ها و آنیون بررسی شد. ظرفیت جذب 19 در محلول هایی با چند ترکیب (حاوی ، Zn2+، Cd2+، Ca2+، Na+) به دست آمده است. وجود Zn و Cd در غلظت های اندک تاثیری بر ظرفیت جذب آمونیوم نداشت. مقایسه ی بین زئولیت های طبیعی و سنتری (مصنوعی)، کارایی حذف آمونیوم توسط توف زئولیت مشابه با زئولیت های 5A و 13X در غلظت پایین آمونیوم اولیه، و بسیار بالاتر از زئولیت ZSM-5 بود.
مطالعه ی سینتیک و تعادل ایزوترم های یون آمونیوم در یک کلینوپتیلولیت طبیعی ترکیه نیز با استفاده از چند تکنیک آزمایشگاهی انجام شده است [64]. تاثیر پارامترهای مربوطه، مانند دما، زمان تماس و غلظت آمونیوم اولیه مورد بررسی قرار گرفت. مدل های Langmuir and Freundlich برای توصیف ایزوترم تعادل برای جذب آمونیوم بکار رفتند و مدل Langmuir انطباق بسیار خوبی با داده های تجربی داشت. پارامترهای ترمودینامیک نشان دادند که تبادل یون آمونیوم توسط کلینوپتیلولیت فرآیندی خودبخودی و گرمازا می باشد.
برخی کلینوپتیلولیت های طبیعی چینی نیز برای از بین بردن آمونیاک مورد آزمایش قرار گرفتند. Wang et al. [65] کاربرد آن را برای حذف آمونیاک از محلول شیرابه لجن های فاضلاب در یک مطالعه دسته ای مورد ارزیابی قرار دادند. تاثیر پارامترهای مربوطه، مانند زمان تماس، غلظت آمونیاک اولیه، و اندازه ذرات کلینوپتیلولیت،، به ترتیب مورد بررسی قرار گرفت. نتایج نشان می دهد که ایزوترم های Langmuir برای جذب یون امونیوم در کلینوپتیلولیت با ماکزیمم ظرفیت جذب 1.74 mg NH4 – N/g معقول تر هستند.
Wen et al. [66] سینتیک جذب سطحی آمونیوم بر روی سه نوع زئولیت، زئولیت طبیعی، زئولیت طبیعی تحت پوشش بیوفیلم، و زئولیت حامل آمونیوم تحت پوشش بیوفیلم مورد مطالعه قرار دادند. تبادل یونی بین و کاتیون ها در زئولیت با کاهش اندازه ذرات زئولیت افزایش یافته است. زئولیت دارای پوشش بیوفیلم تحت تاثیر تبادل یونی قرار نداشت، که به دلیل اندازه ذرات کوچکتر بود، اما ظرفیت تبادل یونی برای اندازه ذرات بزرگتر تا 22% کاهش یافته است. بازتولید زیستی می تواند 78.0 و 63.9% ظرفیت تبادل یونی را به ترتیب برای اندازه های کوچکتر و بزرگتر ذراتِ زئولیت بازیابی نماید. مطالعات تعادل نشان داد که سیستم جذب انطباق مناسبی با ایزوترم Freundlich دارد [67].
Lei et al. [29] تاثیر روش پیش تصفیه یک زئولیت طبیعی چینی را بر جذب آمونیوم مقایسه نمودند. سینتیک های جذب، ایزوترم های تعادل جذب، و تاثیر وجود هر یک از کاتیون های دیگر و اسید هیومیک بر حذف آمونیوم مورد بررسی قرار گرفته است. زئولیت تصفیه شده تحت تابش مایکروویو بالاترین مقدارِ ظرفیت جذب آمونیوم، پس از زئولیت به دست آمده از طریق فرآیند حرارتی و زئولیت تصفیه نشده داشت. پنج مدل ایزوترم برای توصیف داده های ایزوترم بکار رفت و سه مدل ایزوترم سه پارامتری (Redlich–Peterson and Langmuir–Freundlich) بیش از مدلهای ایزوترم دو پارامتری (Freundlich, Temkin, Langmuir)، انطباق بهتری با داده های ایزوترم داشتند.
حضور Na+, K+,Ca2+, Mg2+ می تواند جذب آمونیوم در زئولیت تصفیه شده تحت تابش مایکروویو را کاهش دهد، و ترتیب یون آمونیوم در سایر کاتیون ها Na+> K+ > Ca2+> Mg+2 است، در حالی که وجود اسید هیومیک جذب آمونیوم را افزایش می دهد.
یک کلینوپتیلولیت بیگادیچ طبیعی برای جذب مورد بررسی قرار گرفته است [26]. بررسی های ترمودینامیک نشان داد که آمونیوم حذف شده توسط این کلینوپتیلولیت در دماهای پایین مساعد بود و ماهیتی گرما زا داشت. مدل های ایزوترم متفاوت برای انطباق و برازش با داده های تعادل بررسی شدند و مدل Khan عملکرد بهتری برای مدلسازی داده های تعادلی داشت. به تازگی، Hedstrom and Amofah [72] آزمایشات ستون را برای برآورد ظرفیت جذب آمونیوم توسط کلینوپتیلولیت انجام دادند. نتایج نشان داد که ظرفیت جذب آمونیوم با کاهش اندازه دانه افزایش یافته است، و بالاترین ظرفیت جذب تجربی (آزمایشگاهی) 2.7 mg NH4 – N/g بود.برک ترو (پیشروری) بلافاصله رخ داد که به علت نرخ بارگیری خیلی بالا بود. حدود 23٪ از آمونیوم جذب شده را می توان با آب شیر و دفع واجذب کرد و جذب در شرایط اشباع برجسته تر بود. کلینوپتیلولیت طبیعی ایران برای حذف آمونیاک از محلول های آبی نیز به طور کامل توسط اشرفی زاده و همکاران مورد مطالعه قرار گرفته است [16].
هر دو آزمایشات دسته ای و ستونی انجام شدند. از طریق آزمایشات بچ (دسته ای)، مشخص شد که حذف آمونیاک در 15 دقیقه اول هر زمان تماس، به سرعت رخ داده است. یک ظرفیت جذب در حدود در غلظت خوراک آمونیاک به میزان 50 mg/L به دست آمد و محدوده مطلوب برای PH در حدود 5.5 – 7.6 بود. ظرفیت جذب کلینوپتیلولیت در حالت پیوسته در حدود 15.16 و 15.36 به ترتیب، برای انواع اصلی و بازتولید شده ی کلینوپتیلولیت بود. حضور کاتیون هایی مانند Ca2+, Mg2+, Na+ در محلول خوراک، ظرفیت جذب کلینوپتیلولیت را در حدود کاهش داد. مشخص شده است که مکانیسم اصلی که مسئول جذب یون آمونیوم بر روی زئولیت های طبیعی می باشد، تبادل یونی است.
نتایج ارائه شده در جدول 3 نشان می دهند که ظرفیت جذب کلینوپتیلولیت است. برخی تصفیه های زئولیت کلینوپتیلولیت می تواند ظرفیت جذب را افزایش دهد، به ویژه پس از تبادل Na+ ، که به دلیل میل ترکیبی بالای نسبت به Na+ می باشد. برای سایر انواع زئولیت طبیعی، تبادل یون با مشابه با کلینوپتیلولیت است. ترتیب تبادل یونی زئولیت برای یون های فلزات قلیایی، فلزات قلیایی خاکی، و به ترتیب به صورت > Ba2+> Na+> Ca2+ > Li+ Rb+ > K+ > می باشد. با این حال، سایر اجزاء در محلول مانند یونهای فلزات سنگین و مواد آلی، ظرفیت تبادل یونی آمونیوم را به دلیل جذب رقابتی کاهش خواهند داد. زئولیت طبیعی پس از جذب آمونیوم می تواند از طریق تبادل یون Na یا K یا از طریق تصفیه حرارتی برای فرارزدایی NH3 باز تولید شود.
یون های فلزات سنگین
آلودگی فلزات سنگین در منابع آبی همواره در طی چند دهه گذشته، در نتیجه ی افزایش جمعیت و گشترش فعالیت های صنعتی افزایش یافته است. حضور فلزات سنگین در محیط زیست، به دلیل سمیتی که دارند، یک نگرانی عمده است. مشخص شده است که بسیاری از یونهای فلزات سنگین مشکلات جدی سلامتی و آسیب به گیاهان و حیوانات ایجاد می کنند. بیشتر فلزات سنگین موجود در آبهای آلوده شامل Hg, Pb, Ag, Cu, Cd, Cr, Zn, Ni, Co, Mn هستند. در گذشته، بررسی های گسترده ای با استفاده از زئولیت طبیعی برای جذب یونهای فلزات انجام شده و چندین کار بررسی نیز منتشر شده است [12, 14]. با این حال، این ارزیابی ها بر یک یون فلزی و میل ترکیبی با زئولیت تمرکز داشته اند. در حالی که برای سیستم های واقعی فاضلاب، انواع مختلف آلاینده ها وجود دارد و ممکن است حاوی ترکیبی از انواع یونهای فلزی باشند. در سالهای اخیر، تحقیقات بیشتری در این حوزه متمرکز شده است. جدول 4 ظرفیت جذب انواع مختلف یونهای فلزی با زئولیت های طبیعی مختلف را نشان می دهد.
Panayotova [73] مجموعه ای از آزمایشات را با استفاده از یک زئولیت طبیعی بلغاری و فرم اصلاح شده ی آن برای حذف چندین یون فلزی مانند Ni2+, Cu2+, Cd2+, Zn2+, Pb2+ انجام دادند. در جذب Ni2+ ، زئولیت های طبیعی و اصلاح شده ی – NaOH – , NaCl -, HCl -, CH3COONa در یک فرآیند دسته ای تست شدند. برای زئولیت خام، فرآیند جذب، تابع سینتیک های مرتبه ی اول غیر قابل برگشت است. تعادل جذب را به بهترین نحو می توان از طریق ایزوترم جذب Langmuir توضیح داد. اصلاح زئولیت با CH3COONa و NaCl می تواند جذب Ni2+ را تا 25-30% افزایش دهد. زئولیت های خام و اصلاح شده به آسانی در محلول 2M NaCl بازتولید می شوند. ثابت شده است که برای حذف Cu2+ ، جذب Cu2+ توسط زئولیت از فاضلاب خنثی به اندازه ی رسوب هیدروکسید مس موثر است. حضور همزمان Ca2+ و Mg2+ به میزان قابل ملاحظه ای بر جذب Cu2+ تاثیر نمی گذارد [74]. تعادل جذب را می توان با ایزوترم جذب Langmuir با حداکثر جذب 6.74 mh/g بهتر توضیح داد. زئولیت های اصلاح شده با NaCl, CH3COONa, NaOH توانایی جذب بالاتری از خود نشان دادند. سینتیک و ترمودینامیک های جذب Cd2+ از طریق زئولیت های طبیعی و اصلاح شده، واکنش های برگشت ناپذیرِ مرتبه دوم را نشان دادند و داده های تعادل بهترین انطباق را با ایزوتذم جذب Freundlich داشتند [75]. اما جذب Cd2+ به میزان قابل ملاحظه ای در حضور Ca2+ و Mg2+ کاهش یافتند و زئولیت فرآوری (تصفیه) شده با NaCl و CH3COONa بالاترین توانایی جذب را نشان دادند.
Panayotova and Velikov [76] مطالعات بیشتری را در مورد سینتیک های جذب یونهای کادمیم، سرب، مس، نیکل، و روی از محلول های تک یونی و از ترکیب آنها، با استفاده از سنگ زئولیت بلغاری انجام دادند. مشخص شد که یونهای سرب در محلول های تک یونی و چند یونی، همچنین آب نرم و سخت، به شدت از طریق زئولیت بی حرکت می شوند. بررسی های بیشتر نشان داد که پیش – تصفیه زئولیت با NaCl منجر به افزایش سرعت بی حرکتیِ یونهای فلزات سنگین، همچنین افزایش ضرایب توزیع می شود.
جدول 4: جذب فلزات سنگین در انواع مختلف زئولیت های طبیعی
با این حال، پیش تصفیه زئولیت با NaCl به طور خاص ترتیب گزینش پذیری زئولیت برای یون ها در محلول های چند – جزئی را تغییر نمی دهد [77]. Cincotti et al. [78] کلینوپتیلولیت های طبیعی ساردنی برای حذف فلزات سنگین، مانند سرب، کادمیوم، مس، و روی را به فرم های هومویونی سدیم و قابل قبول بررسی نمودند. مقیاس گزینش پذیری Pb>Cu>Cd بر اساس حداکثر حذف فلزی به دست آمده است.
Inglezakis et al. [79} مطالعه ای را با استفاده از کلینوپتیلولیت طبیعی و بنتونیت برای حذف Pb2+ از محلول های آبی ارائه نمودند. تحت شرایط آزمایشگاهی، بنتونیت برای حذف Pb2+ موثرتر از کلینوپتیلولیت بود. حذف Pb2+ با استفاده از بنتونیت در دمای محیط و با هم زدن ملایم (100 rpm) به 100% رسید، در حالی که بالاترین سطح حذف توسط کلینوپتیلولیت به میزان 55% بود. مشخص شده است که گرد کلینوپتیلولیت کارامدتر از کلینوپتیلولیت گرانولی (دانه ای) است. هم زدن و دما بر جذب Pb2+ ، به ویژه در مورد کلینوپتیلولیت گرانولی تاثیر گذار است (2.5-5.0 mm). جذب سرب با افزایش PH محلول از 1 به 4 افزایش می یابد.
نگهداشتن سرب توسط توف های غنی از کلینوپتیلولیت مکزیکی توسط Llanes-Monter et al. [80] مورد بررسی قرار گرفت. حداکثر ظرفیت تبادل Pb2+ توف های غنی از کلینوپتیلولیت مکزیکی 1.4meq/g در PH 3 بود. گونه زایی شیمیایی سرب، PH، همچنین خواص و مشخصات توف های غنی از کلینوپتیلولیت، فاکتورهای مهمی هستند که باید در فرآیند جذب سرب توسط زئولیت های طبیعی مورد ملاحظه قرار گیرند.
Al-Haj-Ali and Al-Hunaidi [81] به بررسی Pb2+ در فیلیپسیت طبیعی در یک ستون بستر آکنده یا ثابت در مقیاس آزمایشگاهی پرداختند. مدل زمان در سرویس عمق بستر (BDST) بکار رفته است و حاصلِ پارامترها برای طراحی ستون برای یونهای سرب در 5% برک ترو (پیشروی)، یک ظرفیت جذب BDST به اندازه 24.3-35.7 mg/g می باشد.
یک کلینوپتیلولیت طبیعی از ترکیه برای جذب Pb2+, Ni2+, Cu2+, Zn2+ در محلول های تک یونی و ترکیبی توسط Oter and Akcay [82] مورد بررسی قرار گرفت. زمان تماس، PH اولیه محلول، نسبت جامد – به – مایع و غلظت اولیه کاتیون فلزی به صورت پارامترهای جذب یون تکی تعیین شدند. حداکثر ظرفیت جذب به میزان 0.730, 0.251, 0.173 meq/g به ترتیب برای Pb2+, Zn2+, Cu2+, Ni2+ به دست آمده است. با این حال، مقادیر از محلول های یون مخلوط به میزان قابل ملاحظه ای تا 0.299, 0.108, 0.022, 0.017 meq/q به ترتیب برای یون های Pb2+, Zn2+, Cu2+, Ni2+ کاهش یافت. گزینش پذیری کلینوپتیلولیت در هر دو محلول یونی تک یونی و چند یونی به صورت Pb2+> Zn2+> Cu2+> Ni2+ است، که ترتیب مشابهی با گزارش Cincotti et al. [78] دارد.
Payne and Abdel-Fattah [83] مطالعات ایزوترم و سینتیک بچ (دسته ای) را برای مقایسه و ارزیابی انواع مختلف مواد جاذب مانند کربن فعال و زئولیت های طبیعی (کلینوپتیلولیت و شابازیت) و زئولیت های ترکیبی Faujasite (13X) و Linde نوع A (5A) برای حذف Pb2+ انجام دادند. سرعت نسبی برای جذب یون سرب به صورت زیر بود: 13X > chabazite > clinoptilolite > 5A > activated carbon
ایزوترم جذب شابازیت و کلینوپتیلولیت می تواند بهترین انطباق را ایزوترم Freundlich داشته باشند. کاربردهای کلینوپتیلولیت و شابازیت به PH بین 4 و 11 نیاز خواهد داشت، و رقابت یونی موجب کاهش حذف یون سرب توسط زئولیت ها می شود. افزایش دما عملکرد جذب را برای زئولیت ها بهبود می بخشد.
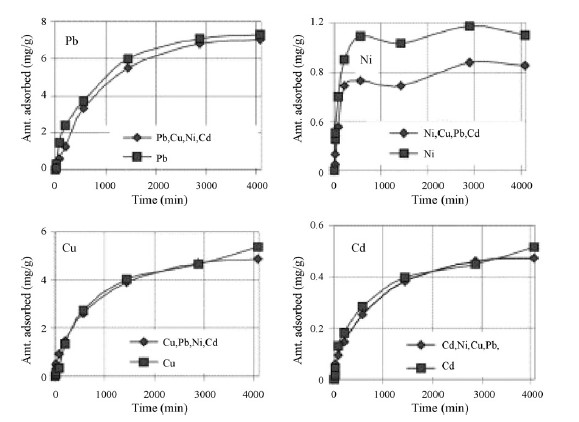
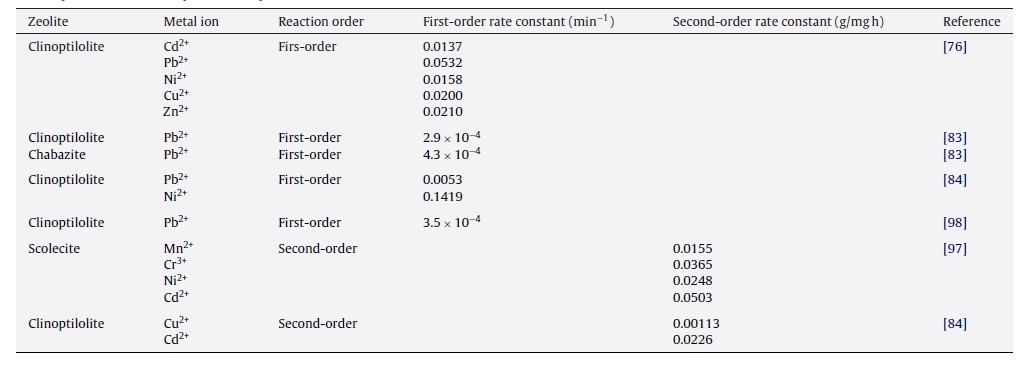
Sprynskyy et al. [84] مطالعه ای در مورد جذب فلزات سنگین (Ni2+, Cu2+, Pb2+, Cd2+) تحت شرایط استاتیک از محلول های آبی تک – و چند جزئی از طریق کلینوپتیلولیت های خام و پیش تصفیه شده انجام دادند. تصویر 2 جذب سینتیک Ni2+, Cu2+, Pb2+, Cd2+ را در سیستم های تک – و چند – جزئی نشان می دهد. آنها دریافتند جذب نوعی فرآیند تبادل یونی است و شامل سه مرحله می باشد؛ یعنی، جذب بر روی سطح میکروکریستال ها، مرحله وارونگی و جذب متوسط در داخل میکرو کریستال.
کسرهای ظریف کلینوپتیلولیت، مقادیر بالاتر فلزات را جذب می کند، که به دلیل غنی سازی نسبی از طریق زئولیت مناسب و شکافتگی بالاتر است. برای Cu2+, Pb2+,Cd2+ هیچ تفاوتی در سیستم های تک – و چند جزئی مشاهده نشده است. کاهش جذب نیکل از محلول های چند جزئی احتمالاً به دلیل قرابت و نزدیکیِ فرم های جذب آن با سایر فلزات و به دلیل رقابت باشد. حداکثر ظرفیت جذب Cd2+ به مقدار 4.22 mg/g در غلظت اولیه 80 mg/L و 27.7, 25.76, 13.03 mg/g در 800 mg/L برای Pb2+, Cu2+, Ni2+ می باشد.
Turkman et al. [85] حذف فلزات سنگین (Pb2+, Cd2+, Ni2+, Zn2+) در پساب های ترکیبی و واقعی را با استفاده از کلینوپتیلولیت طبیعی غیر فعال و فعال بررسی نمودند. زئولیت های گوردس و بیگادیچ در ترکیه برای حذف Cd2+, Ni2+ استفاده شدند و کارایی آنها با زئولیت های طبیعی از نواحی مختلف دیگر مقایسه شده است. اگر چه Cd2+ به طرز موثری توسط زئولیت بیگادیچ حذف نشده است، در حالی که 46% کارایی حذف در زئولیت گوردس پس از 90 دقیقه تماس در تست های دسته ای (بچ) به دست آمده است. مطالعات ستون نیز برای حذف Pb2+, Cd2+, Zn2+ از یک فرآیند استخراج سرب – روی از پساب خام انجام شده است. کارایی حذف کلینوپتیلولیت در حدود 100, 98, 96% به ترتیب برای Pb2+, Zn2+, Cd2+ مشخص شده است.
ظرفیت جذب کلی برای کلینوپتیلولیت بیگادیچ در حدود 23 mg Pb2+ /g ، 24 mg Zn2+/g و 0.6 mg Cd2+ /g بود. Oren and Kaya [86] نیز ویژگیهای جذب Zn2+ زئولیت های گوردس و بیگادیچ را مورد مقایسه قرار دادند. نتایج نشان داد کارایی حذف زئولیت گوردس دو برابر بیشتر از زئولیت بیگادیچ است، که مشابه با نتایج Turkman مشابه است. Gedik and Imamoglu [87] نیز حذف Cd2+ از محلول های آبی را با استفاده از فرم های پیش تصفیه ی NaCl و قابل قبول زئولیت های گوردس و بیگادیچ مورد بررسی قرار دادند. حداکثر ظرفیت های جذب برای نمونه های پذیرفته شده به میزان 0.18 و 0.12 meq/g برای زئولیت های گوردس و بیگادیچ تعیین شد، در حالی که 0.72 و 0.41 meq Cd/g به ترتیب برای فرم های پیش تصفیه آنها تعیین شدند.
تصویر 2: سینتیک های جذب فلزات از محلول های تک – و چند جزئی ( Ni2+, Cu2+, Pb2+, Cd2+) تحت شرایط استاتیک (0.5g زئولیت، کسر 0.71-0.50 mm، محلول 200 mL، C0-20 mg/L برای Cu2+, Ni2+,Pb2+ و C0 – 2 m/L برای Cd2+ ، PH 6.2). [84].
Wingenfelder et al. [88] حذف Fe, Pb, Cd, Zn از آب های معدن سنتزی توسط یک زئولیت طبیعی مورد بررسی قرار دادند. Pb به صورت کارامدی از محلول های خنثی و اسیدی حذف شدند، در حالی که جذب Zn و Cd با کاهش PH و غلظت بالای آهن کاهش یافت. با افزایش غلظت Ca در محلول، حذف Zn و Cd ضعیف تر شد، در حالی که حذف Pb بدون تغییر باقی ماند. این زئولیت در محلول های اسیدی ثابت بود. تجزیه و فروپاشیدگی تنها کمتر از PH 2.0 مشاهده شد.
یک کلینوپتیلولیت طبیعی به یک سیستم اکسید آهن – کلینوپتیلولیت (Clin-Fe) اصلاح شد تا یونهای Mn2+ [89]، Zn2+ [90]، و Cu2+ [91] از نمونه های آب آشامیدنی حذف شوند. تحت شرایط آزمایشگاهی، ماکزیمم مقدار جذب شده Mn برای کلینوپتیلولیت، 7.69 mg/g بود، در حالی که این مقدار برای سیستم Clin – Fe به میزان 27.1 mg/g است. مقادیر مربوطه برای جذب Zn ، 71.3 و 94.8 mg/g بود و ماکزیمم مقدار Cu جذب شده توسط کلینوپتیلولیت، 13.6 mg/g است، در حالی که در سیستم Clin-Fe به میزان 37.5 mg/g بود. این نتایج نشان دهنده ی پیشرفت جذب فلزی با تبادل کننده یونی است.
Stefanovic et al. [92] تاثیر پیش تصفیه توف کلینوپتیلولیت از صربستان را با استفاده از NaCl یا CaCl2 بر جذب Zn2+ مورد بررسی قرار دادیم. پیش تصفیه توف زئولیت، بر ظرفیت جذب و ساختار موضعی (محلی) Zn2+ تاثیر گذاشت. پیش تصفیه توف کلینوپتیلولیت با استفاده از محلول های NaCl یا CaCl2 منجر به جذب بالاتر روی در مقایسه با نمونه زئولیت تصفیه نشده شد؛ یعنی، تا 4 wt% روی در کریستال های کلینوپتیلولیت در فرم پیش تصفیه – Na و تا 1.5 یا 0.6 wt% روی در فرم زئولیت پیش تصفیه – Ca و تصفیه نشده.
Trgo et al. [93] سینتیک حذف یون های روی و سرب از طریق کلینوپتیلولیت اصلاح شده – NaCl را مورد بررسی قرار دادند. سرعت فرآیند تبادل یون برای یونهای سرب سریع تر از یونهای روی است. ظرفیت تبادل یون زئولیت برای یونهای سرب دو برابر بیشتر از یونهای روی است. Bosso and Enzweiler [94] به ارزیابی یک scolecite برای حذف فلزات سنگین (Pb2+, Cu2+, Zn2+, Ni2+, Co2+, Cd2+) از محلول های آبی پرداختند.
نتایج نشان داد که ترتیب میل ترکیبی scolecite برای Cu2+, Zn2+, Pb2+, Ni2+, Co2+, Cd2+ به ترتیب با مقدار حفظ 130, 64, 56, 31, 7.8, 3.2 می باشد.
Alvarez-Ayuso et al. [95] رفتار جذب کلینوپتیلولیت طبیعی و زئولیت های سنتزی NaP1 برای Cr3+, Ni2+, Zn2+, Cu2+, Cd2+ در تصفیه پساب نهایی فلزات مورد مطالعه قرار دادند. زئولیت سنتزی در حدود 10 برابر ظرفیت جذب بیشتری از زئولیت طبیعی نشان دادند. ظرفیت جذب کلینوپتیلولیت طبیعی به میزان 0.079 mmol/g برای Cr، 0.034 mmol/g برای Ni، 0.053 mmol/g برای Zn، 0.093 mmol/g برای Cu و 0.041 mmol/g برای Cd می باشد. این مواد معدنی، هنگامی که در تصفیه پساب های آبکاری الکتریکی فلزات مورد استفاده قرار گرفتند، مقادیر ظرفیت جذب بالای مشابهی نشان دادند.
جدول 5: گزینش پذیری تبادل کاتیون یونهای فلزات سنگین در زئولیت های طبیعی

جدول 6: پارامترهای سینتیک برای جذب یونهای فلزات سنگین در زئولیت های طبیعی
به تازگی، Akgul et al. [96] حذف یونهای نقره از محلول آبی را با استفاده از یک کلینوپتیلولیت طبیعی مورد بررسی قرار دادند. آنها آزمایشات دسته ای (بچ) را برای بررسی تاثیر پارامترهای مختلف مانند PH، زمان جذب، غلظت یون فلزی، و تصفیه اسیدی در فرآیند جذب انجام دادند. آنها دریافتند که تصفیه اسیدی تاثیر قابل ملاحظه ای بر جذب فلزی دارد. به نظر می رسد پدیده های جذب ایزوترم های Langmuir و /freundlich را دنبال کنند و ماکزیمم ظرفیت جذب Ag+ به میزان 33.23 mg Ag+ /g باشد.
برای تبادل یونی با فلزات سنگین مختلف در سیستم های فاضلاب، گزینش پذیری کاتیون زئولیت برای حذف یون انتخابی مهم است. جدول 5 گزینش پذیری تبادل – کاتیون یونهای مهم فلزات سنگین در چند زئولیت طبیعی را نشان می دهد. همانطور که مشاهده می شود Pb میل ترکیبی بالاتری برای تبادل یونی در بیشتر زئولیت ها دارد. سایر یونهای فلزی، بر اساس نوع زئولیت، ترتیب متغیری دارند. قابل ذکر است که گزینش پذیری تبادل یونی نیز بستگی به غلظت یون و PH محلول دارد. بنابراین، این فاکتورها باید در تصفیه ی فاضلاب واقعی مورد ملاحظه قرار گیرند.
برای کاربرد زئولیت در جذب فلزات سنگین، سینتیک های تبادل یونی نیز اهمیت دارد. بررسی های قبلی نشان داده است که جذب یونهای فلزات سنگین معمولاً از دو مدل سینتیک، شبه – مرتبه – اول و شبه – مرتبه – دوم پیروی می کنند. جدول 6 برخی نتایج بررسی های قبلی را نشان می دهد. مشاهده می شود که سینتیک های فلزات سنگین بستگی به نوع زئولیت و یونهای فلزی دارد.
آنیون های معدنی (غیر آلی)
آنیون های معدنی حاوی چندین یون اسیدی و برخی آنیون های شبه فلزی و فلزی هستند. یونهای اسیدی مانند به میزان زیادی در پساب ها موجود هستند. این یون ها می توانند موجب آلودگی های زیادی شوند. سایر آنیون های غیر آلی مهم شامل Cr(V) با فرم های و ، و As(V) با ، و As(III) ، که گونه های سمی قوی در سیستم آب هستند. در حال حاضر، حذف آنیون ها با استفاده از زئولیت های طبیعی در فرم های زئولیت تبادل یونی و سورفاکتانت اصلاح شده قابل دستیابی است.
برای آنیون های اسیدی، زئولیت طبیعی برای جذب F– و CN– تست شدند. Diaz-Nava et al. [99] جذب یونهای فلورید با استفاده از هولاندیت-کلینوپتیلولیت مکزیکی طبیعی مورد بررسی قرار دادند. در کار آنها، تاثیر سدیم، کلسیم، لانتانیم، و اوروپیم در شبکه کریستالی، همچنین تاثیر PH و اندازه ذرات زئولیت بر جذب فلورید ارزیابی شده است. آنها دریافتند نگهداشتن و حفظ فلورید مشابه با نمونه های تصفیه شده و مواد تصفیه نشده با سدیم، کلسیم، لانتانیم، و اوروپیم بود. حفظ فلورید به صورت انسداد و جذب فلورید در زئولیت پیشنهاد شده است.
Samatya et al. [100] نیز زئولیت های با تبادل یون های فلزی (Al3+, La3+, ZrO2+) را برای حذف فلورید از آب در یک کلینوپتیلولیت ترکیه ای آماده ساختند. این نمونه های زئولیت طبیعی از قبل با HNO3 (ZEO-1), NaNO3 (ZEO-2) پیش شرط سازی شدند، و آب (ZEO-3) قبل از بارگذاری Al3+, La3+, ZrO2+ دیونیزه شدند. آنها دریافتند که زئولیت نوع ZEO-1 ظرفیت بیشتری از زئولیت های ZEO-2 و ZEO-3 داشتند. ایزوترم های تعادل انطباق مناسبی با مدلهای Langmuir و Freudlich داشتند. درصد حذف فلورید از محلوب آبی حاوی 2.5 mg F/L با استفاده از زئولیت باردار فلزی (ZEO-1) در غلظت جاذب 6.00 g/L، به اندازه 94% بود. برای زئولیت های تبادل یافته ی Al3+, La3+, ZrO2+، ظرفیت جذب فلورید از ترتیب Zr – Zeo > La-Zeo > Al-Zeo پیروی می کند.
Faghihian [101] آماده سازی و ارزیابی فرم های فلزی اصلاح شده ی مختلفِ کلینوپتیلولیت برای حذف سیانید از محلول های آبی را توضیح دادند. فرم کبالت زئولیت بالاترین جذب 1.95 meq/g-zeolite را نشان داد، در حالی که جذب در فرم های طبیعی به میزان 0.070 meq/g می باشد.
مشخص شده است که کرومیوم (کروم) فلزی، یک فلز بسیار سمی است. وجود آن در آب معمولاً به صورت Cr3+ و Cr(VI) می باشد. در مقایسه با Cr3+، Cr(VI) نگرانی ویژه ای دارد که به دلیل سمت بالاتر آن است. از زمان کار قبلی Haggerty and Bowman [48] که استفاده از سورفاکتانت برای اصلاح بار سطحی زئولیت برای جذب آنیون بود، بررسی های مختلفی صورت گرفته است. Ghiaci et al. [25] عملکرد زئولیت های سنتزی و طبیعی اصلاح شده از طریق HDTMA و CPB، همچنین غربال مولکولی MCM-41 برای حذف کرومات از محلول آبی مقایسه نمودند. کلینوپتیلولیت – HDTMA و CPC جذب بالاتری از جاذب های مبتنی بر ZSM-5 ، اما کمتر از MCM-41 داشتند. ماکزیمم جذب کرومات در کلینوپتیلولیت – HDTMA و CPC بستگی به بارگذاری سورفاکتانت در یک محدوده ی 4.4-16.6 و 3.9 -21.4 mmol/kg دارد. Campos et al. [18] موردنیت اصلاح شده-طبیعی با استفاده از HDTMA و ethylhexadecyldimethylammonium (EHDDMA) به عنوان جاذب هایی برای حذف Cr (VI) از محلول آبی مورد بررسی قرار دادند. نتایج نشان داده است که زئولیت اصلاح شده HDTMA-HSO4 جذب بالاتری برای Cr (VI) بیشتر از زئولیت اصلاح شده – EHDDMA دارد. جذب کرومات در زئولیت – HDTMA ناشی از ترکیب اثراتِ آنتروپی، کولمبیک (coulombic)، آب گریز و یونهای با بار مخالف – HDTMA است. Cordoves et al. [102] نیز بررسی کلینوپتیلولیت اصلاح شده – سورفاکتانت (SMZ) در حذف Cr(VI) و Cr3+ گزارش نمودند. ظرفیت های تبادل کاتیون و آنیون هر زئولیت به دست آمده است. نشان داده شده است که آنالیز توزیع میل ترکیبی در ترکیب با مدل اتصال (همبستگی) فرند لیچ، اجازه ی توصیف خصوصیات پیوند یا اتصال SMZ برای Cr(VI) را فراهم می کند. در مقایسه با سایر کلینوپتیلولیت های اصلاح شده – سورفاکتانت، این زئولیت فعال، ارتقای خواص برای جذب Cr(VI) را ثابت کرد، و روشی برای تفکیک Cr(VI) از Cr3+ ارائه گردید.
Wingenfelder et al. [103] زئولیت اصلاح شده – HDTMA را برای جذب آنتیمونات (آنتیموان) بکار بردند. در طی اصلاح، این زئولیت بیش ار 94% از HDTMA را جذب نمود. واجذبی HDTMA از زئولیت پس از شستشوی سه برابری با آب مقطر، به طور کلی کمتر از 15% بود. اتصال آنتیمونات در زئولیت تصفیه شده با محلولهای HDTMA که ظرفیت بیشتری از ظرفیت تبادل کاتیونی خارجی دارند، موثرترین مورد بود. جذب آنتیمونات بر زئولیت اصلاح شده با ایزوترم های لانگمویر به بهترین نحو توضیح داده شده است. زئولیت – HDTMA در سوسپانسیون (تعلیق) آبی (50 gL) تا 42% آنتیمونان را از محلولهای حاوی 0.09 تا 2.15 mmol Sb/L جذب کردند.
Elizalde-Gonzalez et al. [104] جذب آرسنیک در کلینوپتیلولیت های مکزیک و مجارستان مورد بررسی قرار دادند. هر دوی کلینوپتیلولیت ها قادر به کاهش غلظت آرسنیک اولیه 200 µg/L تا بیش از 75% در آبهای دیونیزه، آشامیدنی، زیر زمینی، و سطحی هستند. در مورد زئولیت مکزیکی، هر دو غلظت های آرسنیت و آرسنات (200 µg/L) می توانند از 200 به 10 µg/L کاهش یابند. مشخص شد که حضور کاتیون ها و آنیون ها در آبهای طبیعی، کارایی زئولیت های انتخاب شده را کاهش نمی دهند. زئولیت مجارستانی 75% آرسنات را حذف نمود و زمانی که نمونه برای اولین بار اسیدی شد، فقط 50% حذف نمود.این زئولیت به طور کامل آرسنیک ثابت را درون حجم آب واجذب نمود. Dousova et al. [105] جذب آرسنات از محلول آبی در سه جاذب، متاکائولین، توف غنی از کلینوپتیلولیت، و زئولیت مصنوعی در هر دو فرم های تصفیه نشده و تصفیه شده – Fe2+ مورد مطالعه قرار دادند. مشخص شد که ظرفیت جذب حلال های تصفیه شده – Fe2+ به میزان قابل ملاحظه ای از حدود 0.5 تا >20.0 mg/g افزایش یافته است، که بیانگر بیش از 95% کل حذف As است.
Habuda-Stanic et al. [106] جاذب های اصلاح شده ی متفاوت (زئولیت کلینوپتیلولیت، شن سبز منگنز و تبادل کاتیونی رزین) برای حذف آرسنیک از آب آشامیدنی آلوده مورد مقایسه قرار دادند. مواد جاذب به صورت شیمیایی اصلاح شدند و با یونهای Fe3+ اشباع شدند، در حالی که محلولهای آرسنیک از طریق آبهای زیر زمینی فرآوری شده آماده شدند. آزمون های جذب نشان می دهد که زئولیت اشباع شده با Fe3+ برای حذف آرسنیک با ظرفیت 55.3 µg/g برای As(III) و 36.4 µg/g برای As(V) موثر است.
Macedo-Miranda and Olguin [107] جذب آرسنیک توسط توف های غنی کلینوپتیلولیت-هولاندیت مکزیکی اصلاح شده با lanthanum، hexadecyltrimethylammonium یا آهن گزارش نمودند. ایزوترم لانگمویر، ظرفیت جذب آرسنیک (V) زئولیت ها را به صورت 75.4 µg As/g در PH 3 ، 3.9 µg As/g در PH 5، و 53.6µg As/g در PH 6 ، برای لانتانیوم، HDTMA و توف غنی هولاندیت کلینوپتیلولیت اصلاح شده با آهن ارائه داده است. به طور کلی، نتایج نشان می دهد که حفظ (احتباس) آرسنیک بستگی به تقدم ماده ی زئولیت، ماهیت گونه های شیمیایی آرسنیک، PH، و مشخصات زئولیت های طبیعی – اصلاح شده دارد.
Davila-Jimenez et al. [108] گونه های یونی را با استفاده از نمک های آهن متفاوت آلی و معدنی، پس از پیش – تصفیه با NaCl، وارد یک توف زئولیتی غنی از کلینوپتیلولیت کردند. آهن وارد شده منطبق با چهار گونه ی هماهنگ شده با هندسه چهار ضلعی می باشد، اساساً چرخش پایین آهن فریک، تقریباً 12 µg/g آرسنیت (حذف 99%) از یک 360 µg(As (III)) / L و 6 µg/g آرسنات از یک 230 µg(As (V)) / L را جذب می کند. جذب آرسنیت و آرسنات به طور خاص در Fe/Si = 0.1 در مجموعه هایی از توف های تبادل یافته به یک سطح پایا رسیده است. اکسیداسیون آرسنیت به آرسنات در محلول در تماس با توف اصلاح شده آهن در طی جذب از طریق گونه زایی مشاهده شده است.
مواد آلی
آلاینده های آلی، آلاینده های مهمی در آب هستند. حذف رنگ ها و مواد آلی با روشی اقتصادی، به عنوان یک مسئله مهم باقی مانده است، اگر چه تعدادی سیستم با تکنیک های جذب توسعه یافته است. مشخص شده است که جذب برای استفاده مجدد از آب با توجه به هزینه اولیه، سادگی طراحی، سادگی عمیات و عدم حساسیت به مواد سمی برتر از سایر تکنیک هاست.
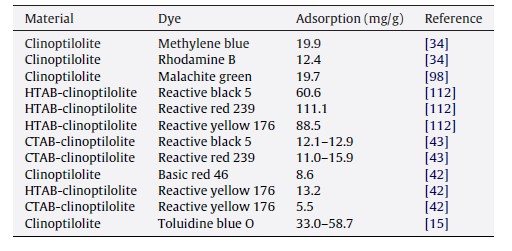
جدول 7: جذب رنگ در زئولیت های طبیعی
جذب رنگ
رنگ ها آلاینده های مهمی در پساب ها هستند که عمدتاً از صنایع نساجی، چاپ، غذا و چرم تخلیه می شوند. انواع رنگهای مختلف، از جمله بازی، اسیدی، واکنشی، و متفرق به طور گسترده ای بکار می روند. رنگ ها در آب ها بر ماهیت آب تاثیر می گذارند، مانع نفوذ نور خورشید به درون جریان آب می شوند و واکنش فوتوسنتزی را کاهش می دهند. برخی رنگ ها سمی و حتی سرطانزا هستند [109]. در سالهای گذشته، برخی بررسی ها با استفاده از زئولیت های طبیعی برای جذب رنگ گزارش شده است، و جدول 7 ظرفیت جذب انواع رنگ ها در زئولیت های طبیعی را نشان می دهد.
Meshko et al. [110] جذب دو رنگ بازی، MG-300 و MG-400 با اجزای (2-[[(4-methoxyphenyl) methylhydrazono]methyl]-1,3,3-trimethylindolium methosulfat) و 2-[[4-[ethyl(2-hydroxyethyl) amino]phenyl]azo]-6- methoxy-3 methylbenzothiazoliumchloride) بر روی کربن فعال گرانولی و کلینوپتیولیت طبیعی بررسی نمودند. تاثیر هم زدن، غلظت اولیه رنگ، و جرم جاذب با استفاده از راکتور دسته ای (بچ) مورد مطالعه قرار گرفته است. مطالعات تعادلی نشان دادند که هر دو رنگها ظرفیت جذب بالاتری برای کربن فعال گرانولی بیش از زئولیت طبیعی دارند. مدل مدل انتشار همگن همراه با مقاومت در برابر انتقال جرم خارجی، بررسی های سینتیک را پیشنهاد می دهند. ظرفیت جذب این دو رنگ در زئولیت های طبیعی به ترتیب 55.9 و 14.9 mg/g می باشد.
Armagan et al. [111–115] یک بررسی جامع بر روی کلینوپتیلولیت ترکیه برای جذب سه رنگ واکنشی آزو (سیاه واکنشی 5، قرمز واکنشی 239، زرد واکنشی 176) انجام دادند و این جذب را با یک نمونه خاک رس، سپیولیت، مقایسه نمودند. نتایج جذب نشان می دهد که هر دو سپیویت طبیعی و زئولیت ظرفیت های جذب محدودی رنگ های واکنشی را دارند. پس از اصلاح با آمین های چهار تایی (hexadecyltrimethylammonium bromide. HTAB)، این جذب به طور قابل ملاحظه ای افزایش یافت. یک مکانیسم جذب الکترواستاتیک شامل شکل گیری یک دولایه ای از مولکولهای آمین بر روی سطح کلینوپتیلولیت که بر روی آن مولکول های رنگ آنیونی جذب می شوند، پیشنهاد شده است. داده های جذب با ایزوترم لانگمویر انطباق یافت و زئولیت اصلاح شده، ظرفیت های جذب 111, 89, 61 mg/g برای قرمز واکنشی، زرد، و سیاه تولید نمودند.
Benkli et al. [44] نیز کلینوپتیلولیت اصلاح شده HTAB برای حذف رنگهای آزو واکنشی، سیاه واکنشی 5، قرمز 239، و زرد 176 در یک بستر ثابت مورد بررسی قرار دادند. نتایج نشان داد که ترتیب حذف رنگ توسط زئولیت اصلاح شده به صورت زیر است: سیاه > زرد > قرمز. محاسبات پوشش HTAB بر سطح زئولیت نشان می دهد که تشکیل دو لایه، منطقی ترین بسته بندی است که حداکثر حذف رنگها را ممکن می سازد.
Karadag et al. [42] نیز زئولیت خام و زئولیت اصلاح شده با سورفاکتانت را برای جذب قرمز بازی 46 (BR46) و زرد واکنشی 176 (RY176) مورد مطالعه قرار دادند و تاثیر سورفاکتانت های مختلف cetyltrimethylammonium bromide (CTAB) و hexadecyltrimethylammonium bromide (HTAB) بر جذب رنگ را مورد مقایسه قرار دادند.
جذب BR46 به زئولیت طبیعی تا حدی با افزایش PH افزایش یافت، در حالی که PH تاثیر قابل توجهی بر جذب RY176 ندارد. افزایش در مقاومت یونی موجب کاهش جذب BR46 و افزایش در جذب RY176 می شود. جذب BR46 بر روی زئولیت طبیعی مطلوب تر از جذب RY176 بر روی زئولیت های اصلاح شده ی CTAB و HTAB می باشد. آنها [46] همچنین زئولیت اصلاح شده CTAB را برای جذب سایر رنگهای واکنشی مورد بررسی قرار دادند. ظرفیت جذب قرمز واکنشی Red 239 دو برابر بیشتر از آبی واکنشی Blue5 بود که به دلیل خاصیت آبدوست مولکولهای رنگ می باشد. مدل شبه – مرتبه – دوم انطباق و ارتباط بسیار خوبی با دو رنگ آنیونی داشت. حداکثر ظرفیت جذب محاسبه شده با افزایش غلظت اولیه رنگ، افزایش یافت، اما هیچ رابطه خطی با PH و دما وجود نداشت.
Alpat et al. [15] نیز کلینوپتیلولیت ترکیه را برای جذب آبی تولوئیدین O (TBO) مورد استفاده قرار دادند. مطالعات سیتیک نشان داد که جذب TBO بر کلینوپتیلولیت با مدل جذب مرتبه دوم با فرآیند انتشار دو مرحله ای تناسب داشت. انرژی های فعال سازی برای جذب TBO بر کلینوپتیلولیت برای فریندهای انتشار اول و دوم، به ترتیب 8.72 و 19.02 kJ/mol بودند. ایزوترم جذب ارتباط مناسبی با هر دو مدلهای لانگمویر و فروندلیچ داشت. حداکثر ظرفیت جذب کلینوپتیلولیت برای TBO به میزان 2.1 × 10-4 mol/g در محلول با PH 11.0 بود.
یک کلینوپتیلولیت طبیعی استرالیا برای جذب رنگ بازی مورد آزمایش قرار گرفت [34]. زئولیت طبیعی دارای حداکثر ظرفیت جذب 2.8 × 10-5 و 7.9 × 10-5 mol/g در 50̊ C به ترتیب برای Rhodamine B و متیلن بلو بود. مطالعات سینتیک نشان داد که جذب بر طبق سینتیک شبه – مرتبه – دوم است و می توان به عنوان فرآیند انتشار دو مرحله ای توضیح داد. همچنین مشخص شد که زئولیت های بازتولید شده از طریق تکلیس در دمای بالا و اکسیداسیون فنتون، ظرفیت جذب مشابهی از خود نشان دادند، اما پایین تر از نمونه تازه بود. فقط 60% ظرفیت را می توان از طریق دو تکنیک بازتولید بازیابی نمود [116].
Wang and Ariyanto [98] نیز جذب رقابتی سبز مالاکیت و یونهای Pb2+ از محلول آبی بر زئولیت طبیعی استرالیایی را مورد بررسی قرار دادند. برای سیستم منفرد، ایزوترم جذب سبز مالاکیت بر طبق مدل لانگمویر است و ظرفیت جذب 5 × 10-5 mol/g می باشد. در سیستم دوتایی (باینری)، سبز مالاکیت و Pb2+ جذب رقابتی به زئولیت طبیعی را نشان می دهد. جذب تا 90 و 80% تک جزئی Pb2+ و سبز مالاکیت کاهش یافته است. با این حال، جذب کلی بالاتر است. در سیستم دوتایی، Pb2+ میل ترکیبی و گزینش پذیری نسبتاً بالایی برای جذب زئولیت را نشان می دهد. اما جذب دینامیک سبز مالاکیت و Pb2+ از سینتیک های مرتبه اول پیروی می کنند.
Han et al. [117] جذب متیلن بلو بر یک زئولیت طبیعی چینی را در آزمونهای ستون تحت سرعت های متفاوت جریان و غلظت های اولیه و برآورد پارامترهای سینتیک مورد بررسی و مطالعه قرار دادند. نتایج نشان داد که زئولیت طبیعی برای حذف متیلن بلو از محلول کارامد بود. داده های برک ترو (پیشروی) با معادلات مدل Thomas انطباق داشتند.
با توجه به ارزیابی های فوق، مشخص است که زئولیت های طبیعی برای جذب رنگ های کاتیونی موثر هستند که به دلیل مشخصات تبادل – کاتیون است، در حالی که ظرفیت پایینی را در رنگهای آنیونی نشان می دهند. پس از اصلاح با سورفاکتانت، زئولیت های طبیعی، جاذب های خوبی برای جذب رنگهای آنیونی خواهند شد.
مواد هیومیکی شده
مواد هیومیکی در حدود 80% مواد آلی خاک در خاکهای تیره را تشکیل می دهند. بیشتر مواد هیومیکی در نتیجه ی فرآیند طبیعی فساد و تجزیه مواد گیاهی هستند. مواد هیومیکی با عنوان اسید هیومیک، اسید فولویک، یا هیومین نیز نامیده می شوند. وجود مواد هیومیکی در آبهای سطحی و زیرزمینی، مواد شیمیایی سمی در طی فرآیند ها گند زدایی (ضد عفونی) تولید خواهند کرد و بنابراین، باید حذف شود. تکنیک های بسیاری برای حذف مواد هیومیکی توسعه یافته اند. برخی محققان، زئولیت طبیعی را برای حذف مواد هیومیکی از طریق جذب بکار برده اند. جدول 8 خلاصه ای از نتایج بررسی های قبلی را ارائه می دهد.
جدول 8: جذب HA توسط زئولیت های طبیعی
Wang et al. [118} یک بررسی از اصلاح سطح کلینوپتیلولیت (SMZ) با HDTMA برای افزایش کارایی حذف اسیدهای فولویک (FA) گزارش داده اند. آنها تاثیرات پارامترهای مربوطه مانند سطوح بارگذاری HDTMA، سرعت جریان FA، و غلظت سیال خروجی در یک بستر ثابت را مورد بررسی قرار دادند. جذب FA بر سطوح SMZ تا حد زیادی به دلیل واکنش آبگریز و پیوند هیدروژن است. مطالعات بهینه سازی نشان داد که بستر SMZ با بارگذاری HDTMA از 120% ECEC با سرعت جریان 5 BV/h، بهترین عملکرد را داشت و حجم 23 BV محلول اتانول 30 vol% با سرعت جریان خوراک (تغذیه) 5 BV/h برای باز تولید کامل SMZ کافی بود.
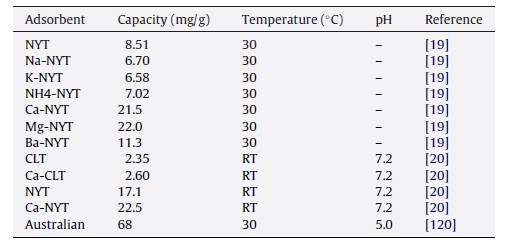
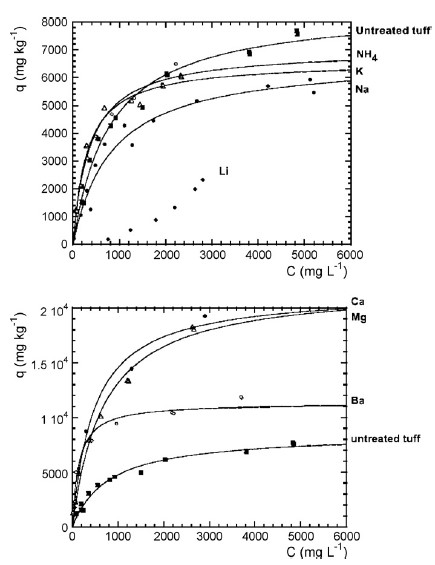
Capasso et al. [19] واکنش اسید هیومیک (HA) با توف زرد ناپلی (NYT) زئولیتی (فیلیپسیت + شابازیت) مورد مطالعه قرار دادند. ایزوترم های جذب HA بر نمونه های تصفیه نشده و غنی از Li+ ، Na+ ، K+، ، Ca2+ ، یا Ba2+ انجام شدند. آنها ماکزیمم مقدار قابل جذب HA و ثابت میل ترکیبی بین سوربانت و جاذب به دست آوردند. تصویر 3 ایزوترم های جذب اسید هیومیک بر زئولیت های مختلف را نشان می دهد. نتایج نشان می دهد که غنی سازی از طریق کاتیون های دو ظرفیتی، توانایی NYT را برای جذب اسید هیومیک افزایش می دهد، در حالی که غنی سازی توسط کاتیون های تک ظرفیتی، جذب را کاهش می دهد. نتایج همچنین نشان داد که جذب اسید هیومیک توسط توف باید به عنوان پدیده ای پیچیده مورد ملاحظه قرار گیرد که برای توافق (مصالحه) بین توانایی کاتیون ها برای تشکیل پل های ثابت با مواد آلی، و به عبارت دیگر، جذب گزینش خاص آنها توسط توف رخ می دهد.
آنها [119] همچنین توانایی NYT غنی شده با یونهای کلسیم را برای حذف اسیدهای هیومیک از آب، از طریق آزمایشات دسته ای (بچ) و ستونی آزمایش کردند. ظرفیت جذب با مقاومت یونی افزایش یافت و بالاترین مقدار را در PH 7.4 داشت. آنها [20] همچنین جذب اسیدهای هیومیک (HA) توسط NYT غنی شده با Ca و یک توف غنی از کلینوپتیلولیت از ترکیه (CLT) مقایسه نمودند. ظرفیت جذب NYT بالاتر از CLT بود. جذب HA توسط NYT غنی از Ca به آسانی یک شبه حالت ثابت ایجاد نمود، پس از آن، سیستم محلول توف / HA در طی چند ماه تکامل یافت تا به حالت تعادل نهایی برسد که مشخصه آن، قابلیت جذب بسیار بالاتر است. آزمایشات دفع (واجذبی) در سطوح بالای PH منجر به بازیابی HA به میزان بیش از 80% شد.
Wang et al. [120] جذب اسید هیومیک (HA) را بر روی توف زئولیت طبیعی استرالیایی بررسی نمودند. ظرفیت جذب اسید هیومیک در دمای 30 ̊C با PH 5 به میزان 68 mg/g به دست آمد. PH محلول بر جذب اسید هیومیک تاثیر می گذارد. در سیستم Pb2+/HA ، Pb2+ جذب رقابتی با هیومیک اسید بر زئولیت طبیعی را نشان می دهد، که منجر به کاهش جذب Pb2+ و همچنین اسید هیومیک می شود. با این حال، در سیستم Cu2+ / HA ، جذب رقابتی و تشکیل کمپلکس بین Cu2+ و هیومیک اسید بر جذب تاثیر می گذارند، که این امر موجب کاهش جذب اسید هیومیک می شود، اما جذب Cu2+ را افزایش می دهد. ساختار کمپلکس سازی Pb-HA/zeolite و Cu-HA/zeolite در سیستم سه – جزئی به ترتیب به صورت S-Pb-HA و
S-HA-Cu پیشنهاد شده است.
بنابراین، مشاهده می شود که زئولیت طبیعی را می توان به عنوان یک جاذب برای جذب مواد هیومیکی نیز بکار برد. با این حال، ظرفیت جذب بستگی به ساختار و ترکیب شیمیایی زئولیت طبیعی بستگی دارد.
تصویر 3: جذی هیومیک اسید توسط توف زئولیت تصفیه نشده و در انواع نمونه های توف غنی از کاتیون
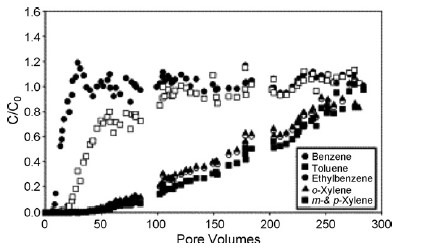
تصویر 4: منحنی پیشروری یا برک ترو BTEX برای آزمایش آب میدان نفتی، اشباع ستون زئولیت اصلاح شده با HDTMA
سایر مواد آلی
صرف نظر از رنگ ها و مواد آلی طبیعی، فاضلاب معمولاً حاوی سایر ترکیبات آلی، مانند ترکیبلت فنولیک، نفت، سورفاکتانت ها، آفت کش ها، و مواد دارویی می باشد که از منابع صنعتی مختلفی هستند. این مواد آلی معمولاً سمی تر از رنگ ها و مواد هیومیکی هستند و حذف این ترکیبات آلی در تصفیه آب و فاضلاب مهم تر است. با این حال، حذف مواد آلی از آب با استفاده از زئولیت طبیعی معمولاً شامل اصلاح سورفاکتانت زئولیت می باشد.
Li and Bowman [121] جذب مواد آلی غیر قطبی، perchloroethylene (PCE)، توسط زئولیت اصلاح شده با HDTMA (SMZ) را مورد بررسی قرار دادند. زیر پوشش تک لایه ای سورفاکتانت، ضریب جذب PCE توسط SMZ متناسب با محتوای کربن آلی کسری بود. بالای پوشش تک لایه ای، افزایش محتوای کربن آلی کسری منجر به افزایش اندکی در ضریب جذب PCE شد. آنها همچنین جذب املاح آلی ionizable، بنزن، فنل، و آنیلین در SMZ را تعیین نمودند [122]. این جذب تحت تاثیر PH محلول، جذب فنل از طریق SMZ تصفیه شده با پوشش دو لایه ای، با افزایش PH افزایش یافت و در نتیجه، کسر phenolate آنیونی افزایش یافت. تعادل یون مخالف نشان داد که افزایش حفظ (احتباس) فنل تا حدی به دلیل تبادل آنیونی phenolate برای برمید بود، مکانیسم مشابهی مسئول جذب آنیون های معدنی توسط SMZ می باشد. در مقابل، کاهش PH منجر به کاهش جذب آنیلین به دلیل غلظت کمتر گونه های خنثی و دفع آنیلیوم بار مثبت از SMZ تصفیه شده با پوشش دو لایه ای بود.
Huttenloch et al. [123] به بررسی دیاتومیت طبیعی اصلاح شده chlorosilanes و مواد زئولیتی برای جذب تولوئن، o-xylene و نفتالین از آب پرداختند. Trimethylchlorosilane (TMSCI)، tert-butyldimethylchlorosilane (TBDMSCI)، dimethyloctadecylchlorosilane (DMODSCI)، و diphenyldichlorosilane (DPDSCI) مورد استفاده قرار گرفتند. آزمون جذب نشان دهنده افزایش جذب در مواد اصلاحی سطحی در مقایسه با مواد تصفیه نشده بود که هیچ جذب قابل اندازه گیری نداشتند. آزمایشات دسته ای (بچ) جذب نشان داد که گروه سر فنیل DPDSCI بهترین میل ترکیبی را با ترکیبات آروماتیک (معطر) دارد. حذف از یک محلول آبی 10 میلی گرم نفتالین، زایلین (o-xylene)، و تولوئن برای کلینوپتیلولیت اصلاح شده به ترتیب 51، 30 و 16% بود.
Ersoy and Celik [124] جذب آنیلین و نیتروبنزن بر روی سطوح زئولیت طبیعی و زئولیت اصلاح شده با HDTMA (OZ) را بررسی نمودند. در آزمون های دسته ای، ظرفیت جذب آنیلین و نیتروبنزن بر سطح زئولیت طبیعی خیلی پایین یا تقریباً هیچ است، اما در سطح OZ قابل توجه می شود. در آزمون های ستونی، ظرفیت جذب این دو ترکیب بر روی OZ از طریق منحنی های برک ترو (پیشروی) به میزان 2.36 و 3.26 mg/g برای آنیلین و نیتروبنزن تعیین شد.
Ghiaci et al. [53] ارگانو – زئولیت ها، ZSM-5 و زئولیت های طبیعی را با HDTMA و n-cetylpyridinium bromide (CPB) آماده کردند و برای جذب آلایندهای آلی غیر یونی (NOCs) مانند بنزن، تولوئن، و فنل از فاضلاب آلوده تست نمودند. آنها دریافتند که افزایش در غلظت NOCs یا غلظت اولیه سورفاکتانت ها منجر به افزایش در جذب NOC می شود. در یک غلظت خاص، زئولیت اصلاح شده CPB جذب بالاتری از زئولیت اصلاح شده با HDTMA نشان داد. کلینوپتیلولیت طبیعی ارگانو، ظرفیت جذب NOCs بالاتر از ZSM-5 ارگانو (organo – ZMS-5) نشان داد.
مطالعه برای ارزیابی زئولیت اصلاح شده با HDTMA (SMZ) برای حذف BTEX از آب تولید شده توسط Ranck et al. [125] گزارش شده است. نتایج نشان داد که SMZ به طور کامل BTEX را حذف نمود و SMZ را می توان از طریق air sparging بدون از دست دادن ظرفیت جذب بازسازی نمود. سیستم در مقیاس میدانی نیز در یک کارخانه تصفیه آب که گاز طبیعی تولید می کند، مورد آزمایش قرار گرفت. در ستون میدان، برک ترو (پیشروی) اولیه ی بنزن در 10 PV رخ داد و برک ترو تولوئن در 15 PV آغاز شد و هیچ پیشروی در اتیل بنزن یا زایلن ها در کل آزمایش 80 PV رخ نداده است.
Bowman [45] به بررسی زئولیت اصلاح شده با HDTMA در یک مانع واکنشی نفوذپذیر برای حذف آلاینده ها از آب زیر سطحی پرداخت. یک تست آزمایشی 15 هفته ای نشان داد ضرایب تاخیری مانع 44 و 39 برای کرومات و PCE می باشد که مشابه با مقادیر پیش بینی شده در آزمایشات لابراتواری بود. او همچنین زئولیت اصلاح شده با HDTMA را برای حذف مواد آلی موجود در پساب های میدان نفتی آزمایش کرد. تصویر 4 اولین آزمایش اشباع BTEX را نشان می دهد. طبق انتظار، گونه های بنزن و تولوئن با حلالیت بالاتر، ابتدا در سیال خروجی ظاهر می شوند و نسبتاً سریع به غلظت های سیال ورودی می رسند، به دنبال آنها، اتیل بنزن آب دوست تر و قویا حفظ شده و زایلنهایی که زمان بیشتری برای رسیدن به غلظت سیال ورودی صرف می کنند. جرم کلی BTEX حفظ شده توسط ستون پر از SMZ برای بنزن 65.3 mg، برای تولوئن 148 mg، برای متیل بنزن 628 mg، برای m-, p-xylene به میزان 698 mg، و برای o-xylene به اندازه 657 mg می باشد. آزمایشات آزمایشگاهی و میدانی نیز نشان دادند که SMZ به اندازه 99-100% باکتری ها و ویروس های موجود در پساب فاضلاب را از بین می برد.
آزمون های جذب سیستماتیک جهتِ تعیین کارایی زئولیت اصلاح شده با SDBAC برای حذف آفت کش ها، آترازین، لیندان، و دیازینون از آب انجام شدند [55]. تاثیر اندازه ذرات جاذب، محتوای جامد در سوسپانسیون (غلظت)، و غلظت اولیه آفت کش در محلول ها مورد بررسی قرار گرفت. ظرفیت جذب، که از طریق انطباق داده های آزمایشگاهی با معادله Langmuir–Freundlich محاسبه شدند، برابر با 2.0 µmol/g (آترازین)، .4 µmol/g (دیازینون)، و 3.4 µmol/g (لیندان) بود. آزمایشات ستونی نشان دادند که در جریان حجمی 6 cm3/min، نقاط برک ترو (پیشروی) (در C/C0=0.1) برابر با 560 حجم بستر (BV) برای لیندان و 620 برای دیازینون بود.
Dakovic et al. [50] به بررسی جذب ochratoxin A (OCHRA) بر روی توف غنی از کلینوپتیلولیت-هولاندیت اصلاح شده با ODMBA در مقادیر متفاوت 20, 50, 100 µmol/g پرداختند، که به صورت OZ-2, OZ-5, OZ-10 نشان داده می شوند. آنها دریافتند که جذب OCHRA بر روی زئولیت های ارگانو بستگی به مقدار کاتیون آلی در سطح، همچنین، غلظت سطح و آرایش زنجیره های قلیایی در در سطح دارد. پوشش سطحی بالای ODMBA منجر به جذب بالاتر OCHRA می شود. در غلظت سطحی کم ODMBA، جذب OCHRA به PH بستگی داشت، در حالی که در غلظت های بالاتر ODMBA، جذب هر دو فرم های خنثی و آنیونی OCHRA رخ داده است.
آنها همچنین جذب زرالنون (ZEN) و fumonisin B-1 (FB1) را [51] در OZ-2, OZ-5, OZ-10 بررسی نمودند. نتایج نشان داد که حضور یونهای ODMBA در سطح زئولیت به میزان گسترده ای جذب ZEN و FB1 را افزایش داده است. PH تاثیر قابل ملاحظه ای بر جذب ZEN و FB1 دارد. حداکثر میزان جذب FB1 برای OZ-10 برآورد شده است که بر اساس مدل لانگمویر، به میزان 10.82 mg/g در PH 3 بود.
Kuleyin [49] جذب فنل و 4- chlorophenolتوسط زئولیت اصلاح شده با HDTMA و BDTDA بررسی نمود. کارایی حذف فنل و 4- chlorophenol توسط زئولیت اصلاح شده با سورفاکتانت بالاتر از زئولیت خنثی بود. راندمان حذف فنل به 71% و 73% برای زئولیت – HDTMA و زئولیت – BDTDA رسد و کارایی حذف 4-chlorophenolبه 81% و 89% برای زئولیت – HDTMA و زئولیت BDTDA در 50 mg/L رسید.
بنابراین، زئولیت طبیعی، جذب اندک مواد آلی در محلول آبی را نشان می دهد، که به دلیل سطح آبدوست آن است. اصلاح با سورفاکتانت می تواند قابلیت های سطح را از طریق افزودن گروههای آبگریز و بنابراین، بالا بردن ظرفیت جذب مواد آلی گوناگون، تغییر دهد. با این حال، جذب بستگی به بارگذاری سورفاکتانت و پوشش روی زئولیت دارد.
نتیجه گیری و چشم انداز آینده
زئولیت های طبیعی، مواد مهم و کم هزینه ای برای تصفیه آب و فاضلاب هستند. زئولیت های طبیعی به دلیل ماهیت تبادل کاتیونی، عملکرد بالایی در جذب کاتیون ها در محلول های آبی مانند آمونیوم و فلزات سنگین نشان می دهند. با این حال، زئولیت ها گزینش پذیریِ یونی متفاوت و جذب رقابتی در یک سیستم چند جرئی نشان داده اند. علاوه بر این، این مواد جاذب های خوبی برای جذب یونهای آنیونی و مواد آلی نمی باشند. اصلاح سطح با استفاده از سورفاکتانت کاتیونی می تواند بار سطحی زئولیت طبیعی را تغییر دهد، و آنها را برای جذب آنیون ها و مواد آلی قابل کاربرد نماید. اصلاح زئولیت های طبیعی با استفاده از برخی فلزات سنگین نیز آنهارا برای جذب آنیون های معدنی توسط رسوب سطحی آماده می کند.
زئولیت طبیعی برای جذب یون کاتیونی به میزان زیادی مورد بررسی قرار گرفته است، با این حال، فرم های اصلاح شده ی آن با استفاده از سورفاکتانت ها برای جذب بون آنیونی به طور جامع مطالعه و بررسی نشده است. مکانیسم دقیق واکنش های آلاینده/ سورفاکتانت/ زئولیت برای طراحی بهتر زئولیت اصلاح شده با سورفاکتانت مورد نیاز است. علاوه بر این، بازیابی (بازسازی) زئولیت مصرف شده با استفاده از روشهای ساده برای بازیافت جاذب در تحقیقات آینده مورد توجه قرار بگیرد.
در گذشته، بیشتر آزمایشات با استفاده از زئولیت طبیعی بر اساس حالت بچ (دسته ای) بود و بر کاربردپذیری و گزینش پذیری آنها تمرکز داشتند. با این حال، هنگامی که شرایط بچ، ظرفیت جذب، و مکانیسم جذب به خوبی مستقر شده باشند، باید در جهت طراحی و اجرای برخی مطالعات آزمایشی در مقیاس کارخانه تلاش نمود تا امکان سنجی آنها در سطح صنعتی مورد بررسی قرار گیرد. مهم تر اینکه، به جای فاضلاب سنتزی (مصنوعی)، فاضلاب واقعی باید مورد آزمایش قرار گیرد.