پلی فریک سولفات (PFS) یکی از منعقد کننده های غیرآلی از پیش پلیمری شده می باشد. نیاز به PFS در کاربرد پلی فریک سولفات در تصفیه آب بسرعت گسترش یافته است، و بنابراین سهم بازار PFS همراه با فعالیت های تولیدی PFS افزایش می یابد. با این وجود، بررسی عملی PFS نسبتاً تحت تأثیر بررسی منعقد کننده های آلومینیومی پلیمری واقع شده است. بنابراین هدف این مطالعه بررسی رویکردهای آماده سازی PFS با روش های مختلف و بررسی اثرات PFS آماده شده با روش های مختلف بر عملکرد انعقادشان می باشد. آزمایشات جار تست برای ارزیاب یراندمان انعقاد در تصفیه آب انجام شدند. پارامترهای کیفی آب، مانند کدورت و رنگ باقیمانده (که بصورت جذب UV254 بیان می شوند)، اندازه گیری شده و برای ارزیابی عملکرد تصفیه مورد استفاده قرار گرفتند.
کار ارائه شده در این مقاله، علم آماده سازی PFS را تعریف نموده و دارای اثر عملی بر آماده سازی و کاربرد منعقد کننده های شیمیایی در تصفیه آب و فاضلاب می باشد. استفاده از محصولات جانبی TiO2 برای آماده سازی PFS، یک روش زیست محیطی برای استفاده مجدد از منابع شیمیایی، صرفه جویی در انرژی و محدود نمودن انتشار کربن می باشد؛ بنابراین، این فرآیند، رویکرد پایداری را برای تولید یک منعقد کننده جهت دستگاه تصفیه آب، ارائه می دهد.
-
مقدمه
پلی فریک سولفات (PFS) توجهات فراوانی را جهت استفاده برای تصفیه آب و فاضلاب بخود جذب نموده است. این ماده شیمیایی یک فرمول کلی داشته، [Fe2(OH)n(SO4)3-n/2]m(n<2,m>10)، و یکی از منعقد کننده های غیرآلی از پیش پلیمری شده بحساب می آید. گزارش شده است که PFS در مقایسه با منعقد کننده های متداول نظیر کلرید آهن و سولفات آلومینیوم راندمان برتری را در حذف مواد آلی طبیعی، کدورت،COD، BOD و یون های فلزات سنگین نشان می دهد. PFS مزایای متعددی را نشان داده است، برای مثال، در بازه وسیعی از pH های انعقاد قابل کاربرد بوده، و لخته هایی با چگالی بالا با رسوبگذاری سریعی را ایجاد می نماید. PFS همچنین می تواند بطور مؤثری در دمای و کدورت پایین در تصفیه آب آشامیدنی و فاضلاب عمل نماید. علاوه بر این، بعضی از مطالعات اولیه درخصوص سمیت نشان می دهند که آب آشامیدنی تصفیه شده با PFS برای مصرف انسان ایمن می باشد.
روش های بسیاری برای تولید PFS به شکل های مایع یا جامد وجود دارد. برای PFS مایع، اکسیداسیون مستقیم سولفات فروس با اکسید کننده های قوی مانند NaClO3، H2O2 و HNO3، پس از هیدرولیز سازی جزئی یا پلیمریزاسیون برای تولید PFS انجام شد. یکی از روش های اکسیداسیون مستقیم، اکسیداسیون کاتالیکی در جایی که اکسیژن یا هوا برای اکسید نمودن Fe2+ به Fe3+ مورد استفاده قرار می گیرد، می باشد. کاتالیزورهایی مانند NOx از NaNO2 و HNO3 مورد نیاز می باشند. همچنین، اکسیداسیون بیولوژیکی در جاییکه باکتری گوگردی-آهن بعنوان اکسید کننده برای اکسید کردن فروس به یون های فریک عمل می کند، قابل دسترس می باشد، و PFS با پلیمری شدن جزئی که در بالا بطور کامل شرح داده شد، تشکیل می شود. PFS جامد می تواند با خشک کردن محلول PFS با خشک کننده سیلندری یا افشاننده یا با سنتز مستقیم با سولفات فروس، اسید نیتریک و آب تولید می شود.
کاربرد PFS در چندین دهه پیشرفت زیادی داشته و فعالیت های تولید آن و سهم بازار در تلفیق با بسط سریع تقاضای منابع آب در صنایع و نیروگاه ها، افزایش می یابد. با این وجود، درمقایسه با تحقیقات درخصوص نمک های پلیمری آهن، تحقیقات کاربردی PFS نسبتاً در سایه نوآوری فناوری تولید PFS قرار گرفته اند.
هدف این کار مطالعه رویکردهای آماده سازی PFS با روش های مختلف و بررسی اثرات روش های آماده سازی بر عملکرد انعقاد PFS می باشد. بخصوص، هدف این مقاله بررسی استفاده از محصولات جانبی TiO2 برای آماده سازی PFS می باشد، که می تواند روشی دوستدار محیط زیست برای استفاده مجدد از منابع شیمیایی، صرفه جویی در انرژی و جلوگیری از انتشار کربن باشد؛ بنابراین، این فرآیند روش مناسبی را برای تولید یک منعقد کننده بمنظور تصفیه آب ارائه می دهد. آزمایشات جارتست برای ارزیابی راندمان انعقاد در تصفیه آب بکار رفتند. پارامترهای کیفی آب، نظیر کدروت و رنگ باقیمانده (که بصورت جذب UV254 بیان می شوند)، اندازه گیری شده و برای ارزیابی عملکرد تصفیه مورد استفاده قرار گرفتند.
-
آزمایشات
1.2. مکانیسم و فناوری آماده سازی پلی فریک سولفات
سنتز PFS با اکسیداسیون سولفات فروس به سولفات آهن در شرایط بشدت اسیدی (H2SO4) آغاز می گردد. وقتی میزان اسید سولفوریک محدود باشد، یون هیدروکسید در مرحله هیدرولیز جایگزین یون سولفات می گردد و بنابراین، پلیمریزاسیون رخ خواهد داد.
PFS 1 بوسیله روش اکسیداسیون کاتالیزور نیتریت سدیم تولید می شود؛ طرح واکنش بشرح زیر مشخص می شود:
واکنش کلی عبارتست از:
4FeSO4.7H2O+(2-n)H2SO4+O2=2Fe2(OH)n(SO4)3-n/2+(30-2n)H2O (5)
PFS 2 با استفاده از اسید نیریک سنتز شده، و طرح واکنش می توان بصورت زیر دیده شود:
24FeSO4+6(2-n)H2SO4+8HNO3+(9n-10)H2O=12Fe2(OH)n(SO4)3-n/2+8NO# (6)
-
آماده سازی پلی فریک سولفات
PFS 1 پس از روش های که در اینجا بطور کامل شرح داده شده اند، تولید شد. 2600 کیلوگرم FeSO4.7H2O (خلوص 90درصد)، 320 کیلوگرم H2SO4 (5/92 درصد)، و 1200 کیلوگرم آب لوله به یک رآکتور همزن با ظرفیت 3 مترمکعب اضافه شده، و با هم زدن مخلوط گردید، و گاز اکسیژن و محلول NaNO2 (20 کیلوگرم NaNO2 محلول در 40 کیلوگرم آب) بداخل رآکتور تخلیه گردید. فشار واکنش در MPa 1/0 کنترل شده و دما در 60 درجه سانتی گراد بمدت یک ساعت کنترل گردید. وقتی غلظت Fe2+ تا 1/0 درصد کاهش یافت، واکنش با متوقف شدن تأمین اکسیژن خاتمه خواهد یافت. این فرآیند 2 ساعت طول خواهد کشید. سپس، محصول PFS درون مخزن نگهداری ریخته شد. مقادیر آهن کل و یون های فروس بترتیب 6/12 و 05/0 درصد بود. قلیاییت با محتوای مواد نامحلول کمتر از 1/0 درصد، برابر با 8/12 درصد بود. سپس محصول مایع بوسیله برج افشاننده (a1 PFS) خشک گردید یا در آون بمدت 2 ساعت در دمای 120 درجه سانتی گراد (b1 PFS) خشک شد. پس از خشک سازی، پارامترهای کیفی محصول اندازه گیری شد: آهن کل: 5/22 درصد، یون های فروس: 09/9 درصد، و قلیاییت: 9/12 درصد.
PFS 2 از پسماندهای صنعتی تولید شد. در تولید اکسید تیتانیوم (TiO2) بوسیله فرآیند سولفات، برای تولید 1 تن TiO2، 6 تن زائدات H2SO4 که بخش جرمی آن 20 درصد می باشد، تولید می شود. تصفیه اسید زائد یکی از مهم ترین کارهای تصفیه آلودگی محیط برای تولید TiO2 می باشد. اسید زائد حاوی رسوب نمک آهن (عمدتاً FeSO4) می باشد، که می تواند بعنوان منابع آهن برای تولید PFS بکار گرفته شود. بنابراین، PFS 2 با استفاده از رسوبات آهن که دارای محتوای Fe برابر با 23 درصد، محتوای Fe2+ برابر با 16 درصد، و محتوای آب برابر با 36 درصد می باشد، آماده گردید. فرآیند سنتز سازی بشرح زیر می باشد: 400 گرم رسوبات آهن و 300 میلی لیتر از H2SO4 50 درصد بواسطه همزدن بمدت 2 ساعت واکنش نشان داد. نیتریک اسید دود کننده به آرامی بعنوان اکسید کننده همراه با همزدن اضافه گردید. این مخلوط بمدت نیم ساعت دیگر به هم زده شد و محتوای Fe2+ تا کمتر از 1/0 درصد کاهش یافت. پس از خشک شدن، نمونه دارای محتوای کل Fe3+ برابر با 6/18 درصد و قلیائیت برابر با 3/10 درصد بود.
بمنظور مقایسه عملکرد انعقاد PFS با پلی آلومینیوم کلرید (PACI)، یک PACI مایع بوسیله روش دو مرحله ای متداول سنتز شد؛ در اینجا بوکسیت، اسید هیدروکلریک و آلومینات کلسیم بعنوان مواد خام مورد استفاده قرار گرفتند. بوکسیت ابتدا با اسید هیدروکلریک واکنش نشان می دهد و سپس با آلومینات کلسیم برای ایجاد غلظت مشخصی از Al2O3 و قلیاییتی معین. PACI مورد استفاده در این مطالعه دارای محتوای Al2O3 برابر با 91/31 درصد و قلیاییت 73/85 درصد بود.
3.2. تعیین ویژگی های پلی فریک سولفات
نمونه های PFS جامد با استفاده از هاون آزمایشگاهی و یک خرد کن برای تعیین ویژگی های آن، ساییده شدند. میکروسکوپ اسکن الکترونی (SEMها) با استفاده از یک XL-30 ESEM انجام شد. طیف مادون قرمز تبدیل فوریه (FTIR) از یک طیف سنج 2000 طیفی FTIR (Perkin-Elmer) بهمراه روش متداول قرص KBr بدست آمد.
4.2. آزمایشات انعقاد
آزمایشات انعقاد با استفاده از دستگاه های جار تست با شش همزن و پس از آن با استفاده از رویکردهای استاندارد جار تست انجام گرفتند. محلول آزمایشی آبدار از سان هائو وو در دانشگاه تونگ جی شانگهای بدست آمد، که نوعی فاضلاب تا اندازه ای آلوده بود. کیفیت ویژگی های عادی محلول آزمایشی در جدول 1 بطور خلاصه بیان شده اند.
شرایط آزمایشگاهی بشرح زیر بود: زمان اختلاط سریع اولیه تا 1 دقیقه با سرعت همزن 300 دور در دقیقه، و پس از آن دوره لخته سازی (تا 10 دقیقه با سرعت همزن 50 دور در دقیقه) و سپس دوره ته نشینی نهایی بمدت 30 دقیقه. پس از آن یک نمونه شناور (100 میلی لیتری) از آنالیز ویژگی های کیفی آب گرفته شد.
کدورت و pH بترتیب با استفاده از کدورت سنج از نوع HACH 2100P و pH سنج از نوع HACH HQ 11 d اندازه گیری شدند. محتوای رنگ مشخص شده بصورت جذب ماورای بنفش در 254 نانومتر با استفاده از طیف سنج مرئی Shimadzo UV-1700 اندازه گیری شد.
-
نتایج و بحث
1.3. آنالیز ساختار و مورفولوژی پلی فریک سولفات
1.1.3. تصاویر SEM نمونه های پلی فریک سولفات
همانگونه که در شکل 1 مشاهده می شود، PFS 1 و PFS 2 بطور کلی بصورت مواد بی شکل رفتار کرده، و بطور تصادفی توده هایی با اندازه ها و شکل های مختلف را تشکیل می دهند. (a) و (b) در شکل 1 روش های مختلف خشک سازی که می توانند شکل های مختلفی بوجود آورند را نشان می دهند.
2.1.3. آنالیز FTIR نمونه های پلی فریک سولفات
طیف های FTIR مربوط به PFS 1 و PFS 2 در شکل 2 نشان داده شده اند. هر دو طیف نشاندهنده دو پیوند مشخص در cm-1 3400 و cm-1 1635 می باشند، که می توانند به ارتعاش ممتد –OH و ارتعاش آب جذب شده، یا کمپلکس در نمونه ها نسبت داده شوند. دو نقطه اوج در cm-1 998 و cm-1 669 بعنوان جذب ارتعاش خمشی Fe-OH در نظر گرفته می شوند. هیچ نقطه اوجی در بازه cm-1 850 تا cm-1 880 وجود ندارد، که این امر نشان می دهد که ساختار PFS جامد دارای دارای پیوند پلی Fe-O-Fe نمی باشد، بلکه دارای پیوند Fe-OH است.
SO42- دارای ساختار چهارضلعی بوده و به گروه نقطه Td با تقارن بالا متعلق می باشد، که از این گروه تنها ارتعاش ممتد متقارن و خمش خارج از صفحه دارای فعالیت مادون قرمز می باشد. تناوب چهارضلعی دو ارتعاش اساسی بترتیب برابرند با cm-1 1130 و cm-1 611. سولفات ها خمش شدیدی را در بازه cm-1 1130 تا cm-1 1080 و نوار بشدت ضعیف تری را در بازه cm-1 680 تا cm-1 610 نشان می دهند. نقاط اوج مختلف در cm-1 1221، cm-1 591 و cm-1 489 را می توان به جذب HSO4– تخصیص داد. cm-1 1130، cm-1 1071 تناوب مشخصی برای SO42-، با نقطه اوجی برابر cm-1 669 می باشند که به جذب ضعیف SO42- تعلق دارند.
2.3. نتایج جار تست ها
در جار تست ها، دوزهای منعقد کننده عبارت بودند از 05/0، 1/0، 15/0، 2/0، 25/0، 3/0 میلی مول بر لیتر آهن. بمنظور مقایسه راندمان نمونه های PFS، آزمایشات مشابهی با استفاده از منعقد کننده های PACI با همان دوزها انجام شد.
رفتار منعقد کننده PACI و PFS از نظر حذف کدورت و NOM (که بصورت UV254 بیان می شود) را می توان در شکل های 3 و 4 مشاهده نمود.
برای حذف کدروت (شکل 3)، PACI عملکرد بهتری برای شرایط مشابه نشان داد. افزایش دوز PFS بیش از 1/0 میلی مول در لیتر آهن هیچگونه بهبود قابل توجهی را در حذف کدورت ایجاد نکرد. با این وجود، تا جاییکه حذف رنگ مد نظر باشد (که در شکل 4 نشان داده شده است)، دو PFS عملکرد بشدت بهتری را نشان دادند؛ نا همخوانی درصدهای حذف UV254 با PFS های مختلف 8/16 درصد بیشتر از PACI برای دوز 05/0 میلی مول در لیتر آلومینیوم یا آهن و شرایط خاص آزمایشگاهی (pH خنثی و دوزهای پایین منعقد کننده ها) بود. با این وجود، می توان خاطرنشان کرد که برای دوزهای مورد مطالعه، PFS رنگ کمتری (بین 33 درصد و 47 درصد) را نسبت به کدورت (75 درصد تا 86 درصد) حذف نمود. با این همه، این امر زمانی که با عملکرد تصفیه PACI مقایسه می شود، صدق کرده و با مطالعات قبلی منطبق می باشد، در این مطالعات حذف کدورت با انعقاد آسان تر از حذف رنگ و مواد آلی بود.
نمونه های PFS روند مشابهی برای حذف کدورت و UV254 نشان دادند. با این وجود، عملکرد PFS 2 نسبت به PFS 1 راندمان کمتری را نشان داد.
همانگونه که در شکل 5 مشاهده می شود، وقتی دوزها در بازه 05/0 تا 2/0 میلی مول بر لیتر بودند، پتانسیل زتای محلول آزمایشی تصفیه شده توسط PFS 1 نسبت به پتانسیل زتای محلول آزمایشی تصفیه شده توسط PFS 2 بیشتر بود. با این وجود، در بازه 05/0 تا 3/0 میلی مول بر لیتر، پتانسیل زتای تصفیه شده توسط PACI بسیار بیشتر از پتانسیل زتای تصفیه شده توسط دو نمونه PFS بود، که می تواند عملکرد بهتر حذف کدورت توسط PACI را شرح دهد.
لازم به ذکر است که pH آب خام پس از تصفیه انعقاد صرف نظر از دوزهای انعقاد و منعقد کننده های مورد استفاده نسبتاً یکنواخت باقی ماند. با این وجود، pH آب تصفیه شده با PACI نسبت به pH آب تصفیه شده با منعقد کننده های PFS کمتر بود؛ به این ترتیب می توان عملکرد مناسب حذف رنگ بدون تغییر pH در پساب تصفیه شده تا مقادیر اندک را حفظ نمود.
-
نتیجه گیری
روش تولید PFS 1، اکسیداسیون نیتریت سدیم، در حال حاضر پرکاربردترین روش در صنعت تولید PFS بحساب می آید. مواد خام PFS 2 محصول جانبی تولید دی اکسید تیتانیوم بود، بدین ترتیب خلوص آن کمتر بوده و نمی تواند در تصفیه آب آشامیدنی بکار رود. بنابراین، این مواد می توانند بازهم در تصفیه فاضلاب بکار روند. از آنجاییکه هزینه های تولید آن بسیار کمتر بوده و این روش تولید از مواد زائد استفاده می نماید، پس به کاهش میزان جامدات زائد دفعی کمک می نماید.
PACI عملکرد مناسبی در حذف کدورت داشت اما بخوبی PFS در حذف UV254 عمل ننمود. علاوه بر این، بعلت مشکلات بهداشتی Al باقیمانده در آب تصفیه شده، استفاده از منعقد کننده های آلومینیومی برای تصفیه آب آشامیدنی دوباره مورد بررسی قرار گرفته و صنایع استفاده از منعقد کننده های آهنی را ترجیح می دهند. پتانسیل استفاده از PFS در تصفیه آب آشامیدنی بالا می باشد. با این وجود، مطالعات عمقی اصل انعقاد و روابط ساختار- فعالیت بمنظور تعیین دوز بهینه براساس کیفیت آب انجام شد. استفاده کامل از محصولات جانبی ناشی از سایر فرآیندها، کاهش مصرف انرژی، بهینه سازی شرایط واکنش و ساده سازی تجهیزات واکنشی برای کاهش هزینه های آماده سازی PFS مورد نیاز می باشند؛ این موارد تحقیقات و مراحل نوآوری برای بررسی کامل PFS در فعالیت های تصفیه آب و فاضلاب را ارائه می دهند.
جدول 1. کیفیت معمولی آب محلول مورد آزمایش.
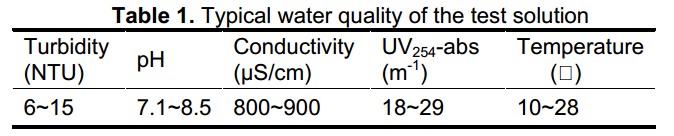
جدول 2. pH آب تصفیه شده.

شکل 1. تصاویر SEM ((a) PFS 1 (خشک کردن با آون)، (b) PFS 1 (خشک کردن با افشاننده)، (c) PFS 2)
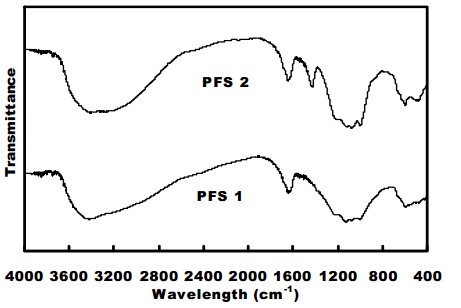
شکل 2. طیف FTIR نمونه های پلی فریک سولفات
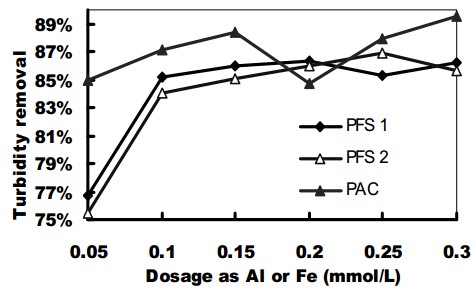
شکل 3. عملکرد حذف کدورت با PFSها و PACI
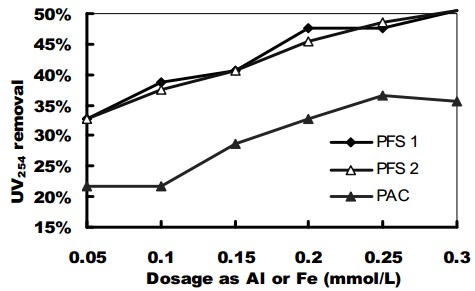
شکل 4. عملکرد حذف UV254 با PFSها و PACI
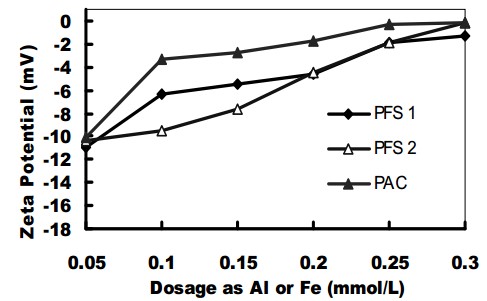
شکل 5. پتانسیل زتا در محلول های آزمایش با PFSها و PACI.